 DATOS
DATOS
 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
 DESCARGAS
DESCARGAS
 DESARROLLOS
DESARROLLOS
 MODIFICACIONES
MODIFICACIONES
 CONCORDANCIAS
CONCORDANCIAS
 NOTIFICACIONES
NOTIFICACIONES
 ACTOS DE TRÁMITE
ACTOS DE TRÁMITE
 ABOGACÍA
ABOGACÍA
 VIDEOS
VIDEOS
RESOLUCIÓN 684 DE 2012
(marzo 28)
Diario Oficial No. 48.388 de 30 de marzo de 2012
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<Ver Notas del Editor, sobre pérdida de fuerza ejecutoria a partir del 16 de diciembre de 2022>
Por la cual se define el Protocolo para la Aprobación de Nuevas Declaraciones de Propiedades de Salud de los Alimentos.
LA MINISTRA DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades legales, en especial, de las contenidas en el numeral 30 del artículo 2o del Decreto-ley 4107 de 2011 y en desarrollo de lo establecido en el artículo 24 de la Resolución 333 de 2011, y
CONSIDERANDO:
Que el artículo 24 de la Resolución 333 de 2011 establece que, “previa comercialización del producto, las declaraciones de propiedades de salud diferentes a las establecidas en el presente reglamento técnico deben ser autorizadas por el Invima de acuerdo con el protocolo que para el efecto defina el Ministerio de la Protección Social”. Adicionalmente, para la renovación del registro sanitario de los productos, el titular debe demostrar el cumplimiento de dicho protocolo con el fin de que el Invima se pronuncie nuevamente sobre la autorización de las declaraciones de propiedades de salud.
Que las solicitudes de autorización de declaraciones de propiedades de salud deben soportarse en fundamentos y evidencias científicas sólidas, que garanticen que en el expediente se recopilen y clasifiquen los datos científicos necesarios para que el Invima evalúe cada solicitud de declaración de propiedad de salud los cuales deben presentarse de forma separada, especificando y cumpliendo con los requerimientos del protocolo.
Que el mencionado protocolo es una guía general para presentar de manera organizada la información científica de soporte que se requiere para la aprobación de nuevas declaraciones de salud de los alimentos, como una medida de protección al consumidor; el cual se define, tomando como base, el dictamen presentado por el comité científico sobre productos dietéticos, nutrición y alergias a solicitud de la Autoridad Europea de Seguridad Alimentaria (EFSA).
Que el artículo 61 del Decreto-ley 4107 de 2011 establece que “Las referencias normativas sobre salud que en las normas anteriores se hagan al Ministerio de Salud y al Ministerio de la Protección Social se entenderán referidas al Ministerio de Salud y Protección Social”.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. Definir el Protocolo para la Aprobación de Nuevas Declaraciones de Propiedades de Salud de los Alimentos de que trata el artículo 24 de la Resolución 333 de 2011, cuyo contenido está previsto en el Anexo Técnico que hace parte integral de la presente resolución.
ARTÍCULO 2o. La revisión y actualización del Protocolo definido en el Anexo Técnico que hace parte integral de la presente resolución procederá en el evento que, de acuerdo con los avances científicos y tecnológicos nacionales e internacionales aceptados, se detecte que las causas que motivaron su expedición, fueron modificadas o desaparecieron.
ARTÍCULO 3o. La presente resolución rige a partir de la fecha de su publicación en el Diario Oficial y deroga las disposiciones que le sean contrarias.
Publíquese y cúmplase.
Dada en Bogotá, a los 28 de marzo de 2012.
La Ministra de Salud y Protección Social,
BEATRIZ LONDOÑO SOTO.
PROTOCOLO PARA LA APROBACIÓN DE NUEVAS DECLARACIONES DE PROPIEDADES DE SALUD DE LOS ALIMENTOS.
INTRODUCCIÓN
El presente protocolo es una herramienta para presentar de manera organizada la información científica de soporte que se requiere para la aprobación de nuevas declaraciones de salud de los alimentos; el cual constituye esencialmente una guía general, por lo que el carácter y dimensión de los estudios necesarios para evaluar el mérito científico de la declaración, puede variar en función de la naturaleza de la misma como una medida de protección al consumidor.
El documento se basa en la Reglamentación de Rotulado Nutricional vigente y tiene en cuenta los siguientes aspectos:
1. La Resolución 0333 de 2011 incluye los requisitos para el uso de declaraciones de propiedades nutricionales y de salud en el etiquetado nutricional.
2. Las solicitudes de autorización de declaraciones de propiedades de salud deben soportarse en fundamentos y evidencias científicas sólidas.
3. La necesidad de establecer un protocolo para la solicitud de declaraciones de propiedades de salud que concuerden con lo establecido en el artículo 24 de la Resolución 0333 de 2011, aquellas que la modifiquen, deroguen o sustituyan.
4. El protocolo debe garantizar que en el expediente de la solicitud se recopilen y clasifiquen los datos científicos necesarios para que el Invima evalúe las solicitudes.
5. El protocolo constituye esencialmente una guía general, por lo que el carácter y dimensión de los estudios necesarios para evaluar el mérito científico de la declaración pueden variar en función de la naturaleza de la misma.
6. Las solicitudes de declaración de propiedades de salud deben tener en cuenta los requisitos estipulados en la Resolución 0333 de 2011 o en aquellas que la modifiquen, deroguen o sustituyan, en especial, las condiciones generales que se indican en los numerales del Capítulo VI. Cada solicitud de declaración de propiedades de salud debe presentarse de forma separada, especificando el tipo de solicitud y cumpliendo con los requerimientos solicitados por el protocolo.
OBJETO
El presente protocolo tiene por objeto establecer requisitos relativos a:
1. Las solicitudes de autorización presentadas conforme al artículo 24 de la Resolución 0333 de 2011.
2. Las solicitudes de inclusión de una declaración de propiedades de salud de acuerdo con las disposiciones generales establecidas en la Resolución 0333 de 2011.
CAMPO DE APLICACIÓN
Las disposiciones establecidas en el presente protocolo aplican a las solicitudes de declaraciones de propiedades de salud en los alimentos para consumo humano. Cada solicitud deberá incluir la relación entre el(los) nutriente(s) u otro(s) compuesto(s) bioactivo(s) en el alimento, o el alimento o la categoría de alimento que lo contiene y el(los) efectos declarados.
DEFINICIONES
Biomarcadores: Son indicadores de cambios medibles, bioquímicos, fisiológicos o morfológicos, que se asocian al consumo de un componente bioactivo.
Categoría de alimento: Grupo de alimentos que comparten una propiedad común de algunos de los alimentos individuales que la conforman.
Componente bioactivo: Compuesto químico, nutriente o no, que ejerce un efecto beneficioso para alguna función corporal del individuo produciendo una mejora en su salud y bienestar o reduciendo un riesgo de enfermedad.
Declaración de función de los nutrientes: Son declaraciones de propiedades que describen la función fisiológica del nutriente en el crecimiento, el desarrollo y las funciones normales del organismo.
Declaración de propiedades de salud: Cualquier representación que declare, sugiera o implique que existe una relación entre un alimento o un constituyente/componente de dicho alimento, y la salud.
Declaraciones de propiedades de otras funciones: Las declaraciones de propiedades conciernen a efectos beneficiosos específicos del consumo de alimentos y sus constituyentes (nutritivos y no nutritivos) sobre las funciones fisiológicas o las actividades biológicas, pero no incluyen declaraciones de propiedades de función de nutrientes. Tales declaraciones de propiedades se relacionan a una contribución positiva a la salud o a una condición vinculada con la salud, o al mejoramiento de una función, o a la modificación o preservación de la salud.
Declaraciones de propiedades respecto a la reducción de riesgos: Son declaraciones de propiedades respecto a la reducción del riesgo de enfermedades, relacionado con el consumo de un alimento o de un componente de dicho alimento en el contexto de una dieta total, que puede ayudar a la reducción del riesgo de una enfermedad o condición precisa. La reducción de riesgos significa el alterar de manera significativa un factor o factores mayores de riesgo reconocidos como involucrados en el desarrollo de una enfermedad crónica o condición adversa relacionada a la salud.
Matriz alimentaria: Son todos los componentes que hacen parte de un alimento interactuando o no entre sí.
Revisión crítica: Es el procedimiento intelectual a través del cual se evalúa una publicación científica a fin de sopesar su valor científico y extraer el conocimiento necesario para sus fines particulares.
ESPECIFICACIÓN DEL TIPO DE DECLARACIÓN DE PROPIEDADES DE SALUD
La solicitud deberá especificar el tipo de declaración de propiedad de salud entre las definidas en el artículo 21 de la Resolución 0333. Además, incluir la propuesta de la declaración de propiedad de salud.
DATOS PROTEGIDOS POR DERECHOS DE PROPIEDAD INTELECTUAL
La información que se considere como datos protegidos por derechos de propiedad intelectual, acompañada de una justificación comprobable, deberá presentarse en una parte separada de la solicitud.
Cuando estos datos sean de propiedad del fabricante del componente bioactivo que proporciona la propiedad de salud al alimento, podrán ser entregados por el fabricante del componente bioactivo al Invima, sin que sea necesario que el fabricante del alimento que presenta la solicitud de aprobación de la declaración de salud, los entregue como parte de su solicitud. Esto puede suceder en cualquier paso del proceso de aprobación, según necesidad.
ESTUDIOS CIENTÍFICOS
Los estudios y otro material relacionado con la justificación de la declaración de propiedades de salud, consistirán principalmente en estudios en humanos y, en el caso de declaraciones relativas al desarrollo y la salud de los niños, en estudios en población infantil.
Los estudios se presentarán según una jerarquía de acuerdo con lo establecido en el Anexo Técnico, en función del diseño del estudio, que refleje la ponderación relativa de las pruebas que puedan obtenerse de los distintos tipos de estudios.
CONDICIONES DE USO
Además de la propuesta de declaración de propiedad de salud mencionada en el aparte de “Especificación del tipo de declaración de propiedades de salud” de este protocolo, la solicitud deberá incluir:
1. La población destinataria de la declaración de propiedad de salud prevista;
2. La cantidad del compuesto bioactivo en el alimento, o del alimento, y el patrón de consumo requerido para obtener el efecto benéfico declarado;
3. Cuando sea pertinente, una indicación destinada a las personas que deben evitar el consumo del compuesto bioactivo, o el alimento, que es objeto de la declaración de propiedad de salud;
4. Cuando sea pertinente una advertencia sobre el compuesto bioactivo, o del alimento, que pueda suponer un riesgo para la salud en caso de consumo excesivo;
5. Cuando sea pertinente, cualquier otra restricción de uso e instrucciones de preparación o uso.
ESTRUCTURA DE LA SOLICITUD
La solicitud deberá elaborarse y presentarse de conformidad con lo establecido en el Anexo Técnico de dicho protocolo.
PROCEDIMIENTOS ADMINISTRATIVOS
La solicitud se radicará en el Invima, entidad que sólo la recibirá si está diligenciado en su totalidad el Apéndice A. Después de la radicación y antes de su evaluación, se verificará que la documentación cumpla con el presente protocolo, para lo cual, el Invima establecerá el procedimiento.
Las declaraciones de las propiedades de salud aprobadas pueden volver a evaluarse a la luz de nuevas pruebas científicas que puedan modificar las conclusiones sobre la relación entre el alimento, categoría de alimento o componente bioactivo y el efecto de salud.
ANEXO TÉCNICO.
ELABORACIÓN Y PRESENTACIÓN DE LAS SOLICITUDES DE DECLARACIONES DE PROPIEDADES DE SALUD.
INTRODUCCIÓN
1. Las disposiciones establecidas en el presente Anexo Técnico aplican a las solicitudes de declaraciones de propiedades de salud en los alimentos para consumo humano.
2. Si alguno de los datos necesarios de conformidad con el presente Anexo Técnico fuera omitido por el solicitante, presumiendo que no es aplicable a la solicitud en cuestión, deben indicarse los motivos por los que no figura tal dato en la solicitud.
3. En lo sucesivo, se entenderá por solicitud al expediente que contenga la información y los datos científicos presentados para obtener la autorización de declaración de propiedad de salud en cuestión.
4. Cada solicitud deberá incluir la relación entre el (los) nutriente(s) u otro(s) compuesto(s) bioactivo(s) en el alimento, o el alimento o la categoría de alimento que lo contiene y el (los) efectos declarados. No obstante, en la misma solicitud se puede proponer que la declaración de propiedad de salud se aplique a distintos alimentos de una misma categoría (Las categorías de alimentos serán las aceptadas por el Invima).
5. En la solicitud debe indicarse si la declaración de propiedad de salud en cuestión, o una declaración similar, ha sido objeto de evaluación científica por autoridades internacionales reconocidas. En tal caso, debe aportarse la información de soporte.
6. No deben citarse resúmenes de revistas especializadas o artículos publicados en periódicos, revistas, boletines, folletos informativos, páginas web o publicaciones electrónicas que no hayan sido revisados por expertos. Tampoco pueden citarse revistas, libros o capítulos de libros destinados a los consumidores o al público en general.
7. La solicitud incluirá en los apéndices solo la información que el solicitante considere pertinente como soporte para la respectiva declaración de propiedad de salud.
PRINCIPIOS GENERALES DEL FUNDAMENTO CIENTÍFICO
1. La solicitud debe contener los datos científicos publicados o no publicados, favorables o desfavorables, que sean pertinentes para la declaración de propiedades de salud, junto con una revisión crítica de los datos procedentes de los estudios entregados, con el objeto de demostrar que dicha declaración está fundamentada en la totalidad de los datos científicos aportados y tras sopesar las pruebas.
2. Se consideran datos científicos pertinentes en seres humanos, los publicados o no, que sean relevantes para fundamentar la declaración de propiedad de salud objeto de la solicitud, al examinar la relación entre el alimento y el efecto declarado, incluidos los datos favorables o no a esa relación. Los datos pertinentes sobre seres humanos que hayan sido publicados deben identificarse mediante una revisión crítica. En el caso de que se declaren propiedades de salud que no puedan medirse directamente se pueden utilizar los biomarcadores validados pertinentes (por ejemplo los niveles plasmáticos de colesterol para la evaluación del riesgo de enfermedades cardiovasculares).
3. La solicitud debe incluir una revisión crítica de los datos procedentes de los estudios en humanos que aborden la relación específica entre el alimento y el efecto declarado. Esta revisión y la identificación de los datos que se consideren pertinentes para la declaración de propiedades de salud deben efectuarse de una forma sistemática y transparente que demuestre que la solicitud refleja de forma adecuada la importancia relativa de todas las pruebas disponibles.
4. El fundamento de las declaraciones de propiedades de salud ha de tener en cuenta la totalidad de los datos científicos aportados y, una vez ponderadas las pruebas, debe demostrar que:
a) el efecto declarado del alimento realmente exista y sea beneficioso para la salud humana;
b) se establece una relación causa efecto entre el consumo del alimento y el efecto declarado en seres humanos;
c) la cantidad del alimento y el patrón de consumo requeridos para obtener el efecto declarado puede alcanzarse razonablemente dentro de una dieta equilibrada;
d) el grupo o grupos específicos estudiados de los que proceden las pruebas tengan características extrapolables a las de la población destinataria de la declaración.
CARACTERÍSTICAS DEL ALIMENTO
Debe proporcionarse la información sobre el componente bioactivo o los alimentos objeto de la declaración de salud, así:
1) Sobre el componente bioactivo:
a) Origen y características:
- Propiedades físicas y químicas
- Composición nutricional
b) Si aplica, anexar características microbiológicas.
2) Sobre el alimento o categoría de alimento:
a) Propiedades físicas y químicas y composición nutricional;
b) Una descripción que incluya una caracterización de su matriz alimentaria;
c) Características de los componentes bioactivos relacionados con la declaración de salud y cantidad necesaria por porción para lograr el beneficio.
3) En ambos casos (componente bioactivo y alimento):
a) Descripción de los métodos analíticos aplicados al producto;
b) Características de almacenamiento y vida útil del producto objeto de la declaración de salud;
c) Si el efecto declarado no depende de un fenómeno de absorción, (como ocurre con los fitoesteroles, la fibra, las bacterias ácido lácticas, entre otros), los datos pertinentes y las razones que demuestren el efecto saludable del componente;
d) Todos los datos disponibles sobre los factores que puedan incidir en el efecto del componente bioactivo evaluado.
ORGANIZACIÓN DE LOS DATOS CIENTÍFICOS PERTINENTES
Los datos científicos que se presenten se deben organizar en la siguiente forma, sin que implique que se deban presentar la totalidad de los tipos de estudios que se describen a continuación:
1. Los datos científicos identificados deben presentarse en el siguiente orden: datos de estudios realizados en seres humanos, seguidos, si procede, por los datos obtenidos de otros estudios (no realizados en seres humanos).
2. Los datos sobre seres humanos se han de clasificar en el siguiente orden, según el diseño del estudio:
a) estudios de intervención en seres humanos, estudios controlados aleatorios, otros estudios aleatorios (no controlados), estudios controlados (no aleatorios) y otros estudios de intervención;
b) estudios de observación en seres humanos, estudios de cohortes, estudios de control de casos, estudios transversales y otros estudios de observación como los reportes de caso;
c) otros estudios sobre seres humanos dedicados a los mecanismos que pueden originar el efecto declarado del alimento, incluidos los estudios sobre la biodisponibilidad.
3. Los datos obtenidos de estudios diferentes a los realizados en seres humanos pueden incluir:
a) datos sobre animales, incluidos los estudios acerca de aspectos relativos a la absorción, la distribución, el metabolismo o la excreción del alimento, estudios sobre el mecanismo de acción y otros estudios;
b) datos ex vivo o in vitro, basados en muestras biológicas humanas o animales vinculados con los mecanismos que pueden originar el efecto declarado del alimento, y otros tipos de estudios no realizados en seres humanos.
RESUMEN DE LOS DATOS CIENTÍFICOS PERTINENTES
Los solicitantes deben proporcionar un resumen de los datos científicos pertinentes, que incluya la siguiente información:
1. Un resumen tabulado con todos los estudios pertinentes presentados identificando los realizados en seres humanos.
2. Un resumen de los datos de los estudios pertinentes sobre seres humanos, que indique en qué medida todos estos datos muestran la relación entre el alimento y el efecto declarado.
3. Un resumen de los datos procedentes de los estudios pertinentes no realizados en seres humanos, que indique de qué manera y en qué medida estos estudios pueden ayudar a mostrar la relación entre el alimento y el efecto declarado en seres humanos.
4. Las conclusiones generales, teniendo en cuenta todos los datos, incluidas las pruebas favorables o desfavorables, y ponderando las mismas. Las conclusiones generales deben definir de manera clara en qué medida se cumple con lo establecido en el numeral 4 de los Principios Generales del Fundamento Científico.
ESTRUCTURA DE LA SOLICITUD
Las solicitudes se deben estructurar de acuerdo con el siguiente esquema. Algunas partes pueden omitirse, siempre que el solicitante lo justifique.
Parte 1. Datos Administrativos y Técnicos
1.1 Índice
1.2 Formato de solicitud (Apéndice A)
1.3 Información general
1.4 Información sobre la declaración de propiedad de salud
1.5 Referencias.
Parte 2. Características del componente bioactivo y/o del alimento que lo contiene
2.1 Componente bioactivo
2.2 Alimento
2.3 Referencias.
Parte 3. Resumen general de los datos científicos pertinentes
3.1 Resumen tabulado de todos los estudios presentados (Apéndice B)
3.2 Resumen tabulado de los datos de los estudios en humanos (Apéndices C y D)
3.3. Resumen escrito de los datos de los estudios en humanos (Apéndice E)
3.4 Resumen de los datos de los estudios realizados en no humanos
3.5 Conclusiones generales.
Parte 4. Datos científicos pertinentes identificados
4.1 Identificación y selección de los datos científicos (Apéndice F)
4.2 Presentación de los datos científicos seleccionados (Apéndice G y H).
Parte 5. Anexos de la Solicitud
5.1 Glosario/abreviaturas
5.2 Copias/separatas de los datos pertinentes publicados.
5.3 Informes de estudios completos sobre datos pertinentes no publicados
5.4 Otros.
Pasos para preparar la solicitud
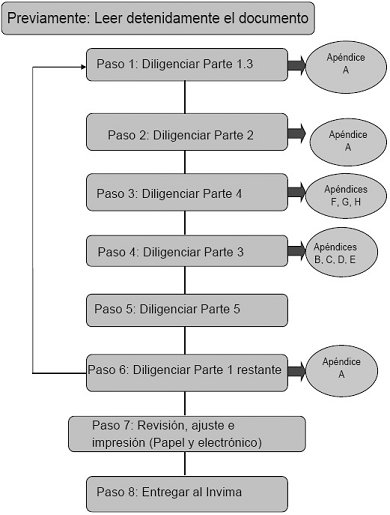
Nota: Los numerales mencionados en el cuadro corresponden a la “Estructura de la solicitud”.
APÉNDICE A
FORMATO DE SOLICITUD (Parte 1 Sección 1.2)
Este formato debe ser utilizado para cualquier solicitud de autorización de declaraciones de propiedades de salud.
Se requiere una solicitud por separado para cada declaración de propiedades de salud.
DECLARACIÓN Y FIRMA
Solicitud enviada al Invima acorde al artículo 24 de la Resolución 0333 de 2011
Alimento/Categoría de Alimento/Compuesto bioactivo:
Propuesta de declaración de propiedad de salud:
Empresa solicitante:
Persona de contacto:
Con la presente confirmo que todos los datos existentes son relevantes para la autorización de la declaración de propiedades de salud han sido suministrados en la solicitud.
En nombre de la empresa solicitante:
| Firma: ______________________________________ | |
| Nombre: | |
| Función: | |
| Ciudad y Fecha: |
INFORMACIÓN GENERAL (Parte 1, Sección 1.3)
Solicitante:
Nombre de la Empresa:
Dirección:
Ciudad:
Persona de contacto autorizada por la Empresa solicitante ante el Invima durante el proceso:
Nombre:
Nombre de la Empresa:
Dirección:
Ciudad:
Teléfono:
Telefax:
Correo electrónico:
INFORMACIÓN SOBRE LA DECLARACIÓN DE PROPIEDAD DE SALUD (Parte 1 Sección 1.4)
Esta solicitud se relaciona con el artículo 24 de la Resolución 0333 de 2011.
Por favor especifique para cuál de los siguientes tipos de declaración de salud aplica la solicitud:
- Declaración de propiedades de función de los nutrientes
- Declaración de propiedades de otras funciones
- Declaración de propiedades de reducción del riesgo de enfermedad.
Por favor especifique si la solicitud:
- Está basada en evidencia científica actualizada
- Incluye una petición para la protección de datos propios.
Indique si la declaración de propiedad de salud solicitada está acorde con:
- Los principios generales referidos en el artículo 5o de la Resolución 0333 de 2011
- Los requisitos generales referidos en el artículo 20 de la Resolución 0333 de 2011.
Indique si la solicitud incluye:
| Datos propios | ||
| Si su respuesta fue Sí, ¿ha suministrado una justificación/declaración verificable? | ||
| Si su respuesta fue Sí, ¿ha identificado debidamente los datos propios en la solicitud? | ||
| Datos confidenciales | ||
| Si su respuesta fue Sí, ¿ha suministrado una justificación/declaración verificable? | ||
| Si su respuesta fue Sí, ¿ha identificado debidamente los datos confidenciales en la solicitud? |
STATUS REGULATORIO NACIONAL E INTERNACIONAL
Indique si la aprobación de esta declaración de salud o una similar ha sido solicitada a través del Invima u otro cuerpo regulatorio internacional.
Si su respuesta fue sí, especifique el estado de la solicitud:
| En consideración | ||
| Aprobada | ||
| Rechazada | ||
| Eliminada |
INFORMACIÓN DE LA DECLARACIÓN DE PROPIEDAD DE SALUD
Especifique el alimento/categoría de alimento/componente bioactivo
Describa la relación entre el alimento/categoría de alimento/componente bioactivo y la declaración de propiedad de salud
Propuesta de declaración de propiedad de salud
Especifique las condiciones de uso.
CONTENIDO DE LA SOLICITUD
Por favor suministre la siguiente información, marcando “Sí” o “No” en el cuadro apropiado
| El objeto de la solicitud ¿es para una sola declaración de propiedad de salud? | Sí | No | |
Partes / secciones de la solicitud
| 2.1 | El alimento / componente bioactivo para el que se solicita la declaración de propiedad de salud ha sido caracterizado (método cuantitativo establecido, AOAC o internacionalmente aceptados, si es nuevo validación de método con análisis estadístico y variabilidad)? | Sí | No |
| 2.1.1 | ¿Ha suministrado las especificaciones del componente bioactivo para las cuales se hace la declaración propiedad de salud? | Sí | No |
| 2.1.2 | ¿Ha suministrado un resumen del proceso de manufactura del componente bioactivo para el cual se solicita la declaración de propiedad de salud? | Sí | No |
| 2.1.3 | ¿Ha suministrado datos relacionados y relevantes sobre la biodisponibilidad del componente bioactivo sobre el que se solicita la declaración de propiedad de salud? | Sí | No |
| 2.2 | ¿Ha sido caracterizado el alimento o categoría del alimento para el que se solicita la declaración de propiedad de salud? | Sí | No |
| 2.2.1 | ¿Presenta las especificaciones del alimento o categoría del alimento para el que se solicita la declaración de propiedad de salud? | Sí | No |
| 2.2.2 | ¿Cuenta con datos relacionados y relevantes sobre la biodisponibilidad del componente bioactivo en el alimento (Variabilidad según la matriz de alimento/variabilidad de biodisponibilidad según el alimento)? | Sí | No |
| 3.1 | ¿Ha suministrado un resumen tabulado de todos los estudios pertinentes presentados? | Sí | No |
| 3.2 | ¿Ha suministrado un resumen tabulado de los datos de los estudios presentados en humanos? | Sí | No |
| 3.3 | ¿Ha suministrado un resumen escrito en español con los datos de los estudios pertinentes en humanos? | Sí | No |
| 3.4 | ¿Ha suministrado un resumen escrito en español con los datos de los estudios pertinentes en no humanos? | Sí | No |
| 3.5 | La conclusión general suministrada ¿ha establecido claramente la relación entre el alimento/componente bioactivo y el efecto declarado con base en los datos y la ponderación de la evidencia? | Sí | No |
| 4.1 | La totalidad de los datos científicos presentados ¿ha sido revisada claramente? | Sí | No |
| 4.1.1 | Algún dato publicado pertinente en humanos ¿ha sido identificado? | Sí | No |
| 4.1.1.1 | Algún dato publicado pertinente en personas colombianas ¿ha sido identificado? | Sí | No |
| 4.1.2 | Algún dato no publicado pertinente en humanos ¿ha sido identificado? | Sí | No |
| 4.1.2.1 | Algún dato no publicado pertinente en personas colombianas ¿ha sido identificado? | Sí | No |
| 4.1.3 | Algún dato publicado pertinente en no-humanos ¿ha sido identificado? | Sí | No |
| 4.1.3.1 | Algún dato publicado pertinente en no-humanos realizado en Colombia ¿ha sido identificado? | Sí | No |
| 4.1.4 | Algún dato no publicado pertinente en no-humanos ¿ha sido identificado? | Sí | No |
| 4.1.4.1 | Algún dato no publicado pertinente en no-humanos realizado en Colombia ¿ha sido identificado? | Sí | No |
| 4.2 | Todos los datos pertinentes ¿han sido presentados? | Sí | No |
| 5.1 | ¿Ha anexado glosarios/abreviaturas, copias/separatas de publicaciones pertinentes identificadas, reportes completos de estudios pertinentes no publicados y opiniones científicas de organismos regulatorios nacionales/internacionales (en español, inglés, portugués, italiano, o traducido al español si es un idioma diferente)? | Sí | No |
| Alguna justificación/razón ¿ha sido dada por la ausencia de los datos anteriores pedidos en la solicitud? | Sí | No | |
Formatos suministrados en los Apéndices
| A | ¿Ha suministrado el formato de la Parte 1-Sección 1.2? | Sí | No |
| B | ¿Ha suministrado el resumen tabulado de todos los estudios pertinentes identificados en la Parte 3-Sección 3.1? | Sí | No |
| C | ¿Ha suministrado el resumen tabulado de los datos de estudios pertinentes de intervención en humanos en la Parte 3-Sección 3.2? | Sí | No |
| D | ¿Ha suministrado el resumen tabulado de los datos de estudios observacionales pertinentes en humanos en la Parte 3-Sección 3.2? | Sí | No |
| E | ¿Ha suministrado el resumen escrito de los datos de estudios pertinentes en humanos en la Parte 3-Sección 3.3? | Sí | No |
| F | ¿Ha suministrado los resultados de la revisión de los datos de estudios en humanos en la Parte 4-Sección 4.1.1? | Sí | No |
| G | ¿Ha suministrado una sinopsis de estudios individuales de intervención pertinente en humanos en la Parte 4-Sección 4.2.1.1? | Sí | No |
| H | ¿Ha suministrado una sinopsis de los estudios observacionales individuales en humanos en la Parte 4-Sección 4.2.1.2? | Sí | No |
Conclusiones Generales
| ¿Existe suficiente evidencia científica de que el efecto declarado del alimento/componente bioactivo es relevante para la salud humana? | Sí | No |
| ¿Existe suficiente evidencia que una relación causa efecto se establece entre el consumo del alimento/componente bioactivo y el efecto declarado en humanos (tales como: fortaleza, consistencia, especificidad, dosis-respuesta, y aceptabilidad biológica de la relación)? | Sí | No |
| ¿Existe suficiente evidencia que la cantidad del alimento/componente bioactivo y el patrón de consumo requerido para obtener el efecto declarado podría ser razonablemente alcanzado como parte de una dieta balanceada? | Sí | No |
| El (los) grupo(s) específico(s) de estudio(s) del cual la evidencia fue obtenida ¿es (son) representativo(s) de la población objeto para la cual la declaración es dirigida? | Sí | No |
APÉNDICE B
RESUMEN TABULADO DE TODOS LOS ESTUDIOS PERTINENTES IDENTIFICADOS
Todos los estudios identificados deben ser incluidos (publicados y no publicados).
Los estudios individuales incluidos en cualquier publicación o revista deben ser enumerados separadamente.
| TIPO DE ESTUDIO | NÚMERO DE ESTUDIOS PUBLICADOS | NÚMERO DE ESTUDIOS NO PUBLICADOS | ||
| Internacionales | Nacionales | Internacionales | Nacionales | |
1. Estudios en humanos[1]
1.1 Estudios experimentales de intervención
a. Estudios completamente aleatorizados[2]
b. Estudios de tipo ciego
c. Estudios no controlados
d. Estudios controlados
e. Estudios aleatorizados y tipo ciego*
f. Estudios aleatorizados y controlados*
g. Estudios aleatorizados, tipo ciego y controlados*
1.2 Estudios de intervención cuasiexperimentales
a. No aleatorizados controlados
b. No aleatorizados no controlados
1.3 Estudios observacionales
a. Estudios de cohorte
b. Estudios de control de casos
c. Estudios transversales
d. Otros estudios (ej. reportes de caso)
1.4 Otros[3]
2. Estudios diferentes a los realizados en seres humanos
2.1 Estudios en animales[4]
2.2 Estudios ex vivo/in vitro[5]
2.3 Otros[6]
TOTAL
* Cuando el estudio corresponda a una combinación, no marcar las casillas independientes.
APÉNDICE C
RESUMEN TABULADO DE LOS DATOS DE ESTUDIOS DE INTERVENCIÓN EN HUMANOS
1. Adjunte una tabla resumen de los resultados de todos los estudios de intervención en humanos que establezcan una relación entre el consumo del alimento/componente bioactivo y el efecto declarado. 1 2 3 4 5 6
Si hay más de una intervención (por ejemplo, diferentes dosis de un alimento/componente bioactivo) que es reportado en el mismo estudio, se debe usar una línea más por cada estudio indicando cuál es el grupo de intervención que ha sido considerado. Se debe listar los estudios de intervención por jerarquía de diseño del estudio así:
- Estudios aleatorizados controlados
- Otros estudios aleatorizados (no controlados)
- Estudios controlados no aleatorizados
- Nuevos estudios de intervención
EFECTOS DECLARADOS
| Estudios (Autor, país y año de publicación) | Intervención (Solo para estudios con más de un grupo de intervención) | Intervención n/N (Número de sujetos que recibieron la intervención/ Número total de sujetos) | Control n/N (Número de sujetos que recibieron el control/ Número total de sujetos) | RR (95% Mínimo Intervalo de Confianza) |
Grupo de intervención 1
Grupo de intervención 2
Grupo de intervención n
2. Si hay disponibilidad de revisiones sistemáticas publicadas, agrupación de análisis o meta-análisis de estudios de intervención en humanos que investiguen la relación entre el consumo del alimento/componente bioactivo y el efecto declarado pueden ser presentados en la parte 3 Sección 3.3 indicando el protocolo utilizado para la realización de la revisión sistemática o el resumen de lo resultados relevantes.
APÉNDICE D
RESUMEN TABULADO DE LOS ESTUDIOS OBSERVACIONALES PERTINENTES EN HUMANOS
Esta guía es aplicable a la Parte 3, sección 3.2.
Suministre una tabla resumiendo los resultados de estudios observacionales enfocados a la relación entre el consumo del alimento/componente bioactivo y el efecto a declarar. Si hay más de un nivel de exposición (ejemplo diferentes niveles de alimento/componente bioactivo) reportado en un mismo estudio, use más de un renglón para ese estudio indicando qué grupo de exposición se está considerando (ver tabla ejemplo). Enumere los estudios observacionales por jerarquía como sigue: estudios de cohorte, estudios de caso-control, estudios cruzados y otros estudios observacionales.
Efecto declarado (o biomarcador sustituto del efecto declarado)*
| Estudios ** | Exposición*** | Exposición n/N | Control n/N | Riesgo Relativo (95%IC) |
| Estudio 1 | Exposición 1 | |||
| Estudio 1 | Exposición 2 | |||
Estudio 2
Estudio n
Adicione renglones si es necesario
*Esta tabla es solo un ejemplo y podría ser adaptada para acomodar diferentes tipos de diseños de estudios. Sin embargo, se requiere una tabla agrupando los estudios individuales para investigar la relación entre el consumo del alimento/componente bioactivo y cada resultado (o el efecto declarado o un marcador sustituto del efecto declarado).
** Indique primero el autor y el año de publicación.
*** Se completa solo en estudios con más de un nivel de exposición
n/N = número de sujetos en la exposición o grupo control/número total de sujetos.
RR (95%IC) = Riesgo Relativo (95% de intervalo de confianza).
2. De ser posible, proporcione un análisis gráfico (ejemplo plot forestal) resumiendo los resultados de estudios observacionales enfocados a la relación entre el consumo del alimento/componente bioactivo y el efecto de propiedad de salud declarado. Especifique si el análisis gráfico presentado es:
a. Sin meta-análisis.
b. Con meta-análisis (modelo de efecto fijo).
c. Con meta-análisis (modelo de efectos al azar).
En los casos b. y c., donde se realiza una meta-análisis de los estudios, se debe suministrar un reporte detallado del protocolo seguido para conducir el estudio bajo la Parte 5, sección 5.3.
3. Si se dispone de revisiones sistemáticas publicadas, de análisis agrupados o de meta-análisis, de estudios observacionales para investigar la relación entre el consumo de un alimento/componente bioactivo y el efecto declarado deberá ser presentado en la Parte 3 sección 3.3 (Apéndice E) indicando la metodología utilizada para realizar la revisión sistemática y resumiendo los resultados relevantes. Únicamente cuando la pregunta enfocada por los estudios es relevante directamente con la declaración de propiedad de salud aplicada en los estudios individuales incluidos en las revisiones sistemáticas, los análisis agrupados o las meta-análisis no necesita ser presentadas separadamente en la aplicación (Parte 4, sección 4.2.1.2). En la Parte 5, sección 5.2 se deberán anexar las copias/ separatas de las revisiones sistemáticas, de los análisis agrupados o de los meta-análisis, junto con las copias/separatas de los estudios individuales y de los estudios originales incluidos.
APÉNDICE E
RESUMEN ESCRITO DE DATOS DE ESTUDIOS PERTINENTES EN HUMANOS
(i) Instrucciones de uso:
Esta guía es aplicable a la Parte 3, Sección 3.3 y está destinada a ayudar a los solicitantes en el resumen de los datos científicos que se han suministrado en la Parte 4. Por lo tanto, es aconsejable iniciar con la preparación y finalización de la Parte 4, antes de iniciar la Parte 3, Sección 3.3
(ii) Principios generales y secuencia de la información:
El resumen escrito está destinado a suministrar un resumen de los datos en humanos presentados en la Parte 4 y en el formato tabulado en la Sección 3.2 de la solicitud. El resumen deberá incluir información resultante de la revisión integral de los datos presentados publicados, de los datos no publicados, incluyendo estudios a favor y en contra, referencias cruzadas sobre los estudios pertinentes en humanos (de intervención u observacional) proporcionados en la Parte 4 y en el Resumen Tabulado (Sección 3.2) deberán ser dados, cuando y como sea apropiado, para enfocar los siguientes puntos:
Primero, la relación entre el consumo del alimento/componente bioactivo y el efecto declarado deberá se caracterizado considerando, por ejemplo:
-- La magnitud del efecto y su relevancia fisiológica,
-- La población de estudio en la cual se ha observado el efecto y si esta es representativa de la población objeto,
-- Las condiciones bajo las cuales el efecto ha sido realizado u observado (habitación metabólica, instalaciones clínicas, voluntarios viviendo libremente, etc.),
-- La sostenibilidad de tal efecto a lo largo del tiempo,
-- La cantidad de alimento/componente bioactivo utilizado para alcanzar el efecto, la ingesta usual de alimento/componente bioactivo en la población objeto y si esta cantidad podrá ser razonablemente consumida como parte de una dieta balanceada.
Segundo, hasta qué extensión los datos sustentan una relación causal entre el consumo del alimento/componente bioactivo y el efecto declarado, podrá ser enfocado al considerar:
-- La consistencia de los resultados de estudios,
-- La magnitud del efecto, su significado estadístico, la presencia/ausencia de evidencia igualmente sólida, neutra o contraria,
-- Si es disponible, una cantidad efectiva,
-- Entre los elementos a ser considerados están la veracidad biológica, explicaciones alternas para el efecto observado y la especificidad de la relación causa-efecto.
APÉNDICE F
RESULTADOS DE LAS REVISIONES DE DATOS EN HUMANOS.
Debe ser completado por el solicitante para su inclusión en la Parte 4.
Relacione el número de las publicaciones seleccionadas en la revisión de datos en humanos por tipo de publicación.
| Tipo de publicación | Número de publicaciones seleccionadas | Número de publicaciones excluidas |
Datos en Humanos[7] (Total 1 a 8)
1. Investigación Total (Total a+b)
a. Estudios de Intervención
b. Estudios Observacionales
2. Análisis agrupados de estudios de intervención en humanos.
3. Meta-análisis de estudios de intervención en humanos.
4. Análisis agrupado de estudios observacionales en humanos
5. Meta-análisis de estudios observacionales en humanos
6. Revisiones Sistemáticas
7. Otras revisiones de publicaciones
8. Directrices /opiniones y consensos/capítulos de libros
9. Otro[8]
APÉNDICE G
SINOPSIS DE ESTUDIOS INDIVIDUALES PERTINENTES DE INTERVENCIÓN EN SERES HUMANOS
ESTUDIOS
Por favor entregue un resumen de cada estudio
Los datos de abajo deberán ser extraídos de copias/separatas de estudios publicados y de reportes completos de reporte de estudios no publicados.
Debido a que no todos los datos de abajo pueden estar disponibles en todos los casos, por favor indique “no disponible” donde sea apropiado.
Para ser incluido bajo la parte 4.
1. Identificación del Estudio
1.1. Autores: ___________________________________________________
1.2. Título del Artículo: __________________________________________
1.3. Fuente (Revista, conferencia, etc.) Año/Volumen/páginas/país de origen: ___________________________________________________
1.4. Afiliación Institucional (primer autor) y/o dirección de contacto: _______
1.5. Declaración de interés: ________________________________________
1.6. Fuente de financiación: ________________________________________
1.7. Estado de Buena Práctica Clínica/aprobación ética:__________________
2. Estado del Reporte. Por favor complete según sea apropiado:
| Publicado | Aceptado para publicación | Sin publicar |
3. Verificación de elegibilidad del estudio (verificar si el estudio de intervención cumple con los criterios de inclusión definidos en la Parte 4, sobre la revisión crítica de Datos en Humanos): _____________________
4. Objetivo(s) del Estudio: __________________________________________________________________________________________________________________________________________________
5. Descripción de la Población de estudio
5.1. Subgrupo de Población (si no es Población en general): ____________
5.2. Rangos(s) de edad:__________________________________________
5.3. Sexo: _____________________________________________________
5.4. Etnia: _____________________________________________________
5.5. Criterio de Inclusión: _________________________________________
5.6. Criterio de Exclusión: ________________________________________
5.7. Características: _____________________________________________
5.8. Región(es) Geográfica(s): _____________________________________
6. Diseño del Estudio
6.1. Diseño: Pruebas aleatorias controladas, estudios cruzados, otro: ______
6.2. Rama(s) de la intervención: (Llenar los recuadros de abajo según corresponda (usar N/A cuando no aplique).
| Alimento/ componente bioactivo | Matriz Alimentaria si aplica | Ingesta Diaria (Componente bioactivo) | Ingesta Diaria (Alimento) | Duración de la Intervención | Duración del seguimiento |
Intervención 1= Control
Intervención 2
Intervención 3
Intervención 4
Intervención n
Adicionar filas si es necesario
Número de Sujetos asignados a cada rama de la intervención: ________
6.3. Resultado primario: Establecer la variable usada para la ponderación estadística (cifras significativas, significado estadístico).
6.4. Resultado(s) secundario: Variable 1, Variable 2, Variable n. ___________
6.5. Equivalencia entre sujetos de grupos de estudio (ramas) en la línea base.
6.6. Variables revisadas para: Variable1, Variable 2, variable n
7. Resultados del estudio:
7.1. Abandonos durante la intervención (incluyendo controles, si es aplicable): ________________________________________________________________________
7.2. Efectos adversos en el control y en la intervención, Si cualquiera es reportado: _____________________________________________________________________
7.3. Valores pre y posensayo (promedios/medianas + DE/SEM/rangos intercuartiles) diferencia de promedios (± DE/SEM/95%C) para resultados primarios y secundarios, y significado estadístico de los resultados:
_____________________________________________________________________
| Variable 1 | Pre-test | Post-test | Promedio diferencia | P-1* | P-2** | Seguimiento | Promedio diferencia | P-1* | P-2** |
Controles
Intervención 1
Intervención 2
Intervención n
Adición líneas si es necesario
| Variable 1 | Pre-test | Post-test | Promedio diferencia | P-1* | P-2** | Seguimiento | Promedio diferencia | P-1* | P-2** |
Controles
Intervención 1
Intervención 2
Intervención n
Adición líneas si es necesario
Esta tabla es solo un ejemplo y podría ser adaptada para acomodar diferentes tipos de diseños de estudio.
Los valores se expresan como: (media/media ± SD/SEM/rangos intercuartiles/95%CIs, según sea apropiado).
* P-1= Significancia para cambios en la variable considerada durante cada tratamiento.
**P-2 = Significancia para cambios en la variable considerada durante cada tratamiento según es comparada al grupo de control.
7.4 Señale la relevancia biológica de los resultados ______________________________
8. Calidad del estudio. Por favor revisar las columnas apropiadas en la tabla de abajo.
Si las copias/separatas de estudios publicados o reportes completos de estudios no publicados no contienen suficiente información para evaluar algunos de los puntos de abajo, por favor marcar en el recuadro “No” o “Desconocido”, según corresponda. 9 10 11
| Sí | Parcialmente | No | Desconocido | N/A[9] | |
| 1. Ponderación estadístico efectuado | |||||
| 2. Características reportadas de la línea base | |||||
| 3. Criterios específicos de inclusión y exclusión de sujetos. | |||||
| 4. Información sobre antecedentes de hábitos alimenticios | |||||
| 5. Información sobre actividad física. | |||||
| 6. Información sobre consumo de alcohol y tabaquismo | |||||
| 7. Información sobre uso de medicamentos. | |||||
| 8. Información sobre otros factores de riesgo. | |||||
| 9. Distribución aleatoria. | |||||
| a. Secuencia aleatoria de Generación | |||||
| b. Asignación ciega | |||||
| 10. Grupo(s) Control y Grupo(s) de Intervención(es) comparables a la línea base para factores de riesgo relevantes/variables resultado | |||||
| 11. Estudios ciego | |||||
| 12. Estudios doble ciego[10] | |||||
| 13. Estudios triple ciego[11] | |||||
| 14. Consentimiento informado | |||||
| 15. Duración de la intervención(es) adecuada(s) para probar la hipótesis | |||||
| 16. Estimaciones Puntuales y Variabilidad reportada de la principal variable resultado | |||||
| 17. Sustituir marcadores del efecto alegado validado analíticamente | |||||
| 18. Sustituir marcadores del efecto alegado validado biológicamente | |||||
| 19. Análisis incluyen una intención para tratar análisis | |||||
| 20. Adaptación efectuada para potenciales distorsionantes | |||||
9. Conclusiones del Solicitante (15 líneas máximo)
APÉNDICE H
SINOPSIS DE LOS ESTUDIOS OBSERVACIONALES INDIVIDUALES EN HUMANOS
Por favor entregue una sinopsis de cada estudio.
Los datos deben ser obtenidos de copias/separatas de estudios publicados o de reportes completos de estudios no publicados; ya que no todos los datos pueden estar disponibles en todos los casos, por favor indique “no disponible” donde sea apropiado.
Para ser incluido bajo la Parte 4.
1. Identificación de datos científicos pertinentes
1.1. Autores: _____________________________________________________
1.2. Título del artículo: _____________________________________________
1.3. Fuente (revista, conferencia, etc.). Año/Volumen/páginas/país de origen:
_________________________________________________________________
1.4. Filiación institucional (Primer autor) y/o dirección de contacto: ___________
Declaración de intereses: ____________________________________________
Fuentes de financiación: _____________________________________________
Aprobación ética: _________________________________________________
2. Estado del reporte. Por favor indique lo apropiado:
| Publicado | Aceptado para publicación | Sin publicar |
3. Verificación de elegibilidad del estudio. Verifique si el estudio de intervención cumple con los criterios de inclusión definidos en la Parte 4, sobre Revisión crítica de datos en humanos.
4. Objetivo(s) del Estudio: _______________________________
5. Descripción de la Población de estudio
5.1. Subgrupo de población (si no es población en general): ______________
5.2. Rango(s) de edad: ___________________________________________
5.3. Sexo: ______________________________________________________
5.4. Etnia: ______________________________________________________
5.5. Criterio de Inclusión (para casos y controles, si es apropiado): _________
5.6. Criterio de Exclusión (para casos y controles, si es apropiado): _________
5.7. Procedimientos de selección utilizados (consecutivo, arbitrario, no reportado, otros):
_______________________________________________________________
5.8. Características: ________________________________________________
5.9. Región(es) Geográfica(s): ________________________________________
6. Diseño del estudio
6.1. Diseño: cohorte, caso-control, caso-reporte, cruzado: ___________________
6.2. Recolección de datos (prospectivo, retrospectivo, no reportado, otro): ______
6.3. Exposición (es): llenen los siguientes renglones apropiadamente. Utilice N/A cuando no es aplicable:
| Alimento/ componente bioactivo | Matriz alimenticia, si es aplicable | Ingesta diaria (componente bioactivo ) | Ingesta diaria (Alimento) | Duración de la exposición |
Exposición 1= Control
Exposición 2
Exposición n
6.4 .Número de sujetos (total, por cohorte, por grupo):________________________
6.5. Resultados primarios: establezca la variable usada para los cálculos de “potencia”,
si cualquiera _______________________________________________________
6.6. Resultado (s) secundario(s): variable 1, variable 2, variable n: ______________
6.7. Comparabilidad de los sujetos entre grupos de estudio en la línea base.
Variables verificadas para variable 1, variable 2, variable n
7. Evaluación de respuestas y resultados
7.1. Duración del seguimiento, si aplica: __________________________________
7.2. Abandonos en total por grupo. ______________________________________
7.3. Efectos adversos reportados: _______________________________________
7.4. Evaluación de los efectos de la exposición: reporte de las medidas apropiadas de las variables de repuesta: _______________________________________
7.5. Enfoque de la relevancia biológica de los resultados: ____________________
8. Calidad del estudio. Señale la columna apropiada en la siguiente tabla. Si las copias/separatas de los estudios publicados o de los reportes completos o de los estudios no publicados no contienen suficientes datos para valorar algunos de los puntos indicados abajo por favor anote “No” o “Desconocido” donde sea apropiado.
| Sí | Parcialmente | No | Desconocido | N/A[1*] | |
| 1. Ponderación estadística efectuada | |||||
| 2. Características iniciales de los sujetos reportados | |||||
| 3. Criterios específicos de inclusión y exclusión de sujetos | |||||
| 4. Definición explícita de casos | |||||
| 5. Condición de casos confiablemente evaluados y validados | |||||
| 6. Controles seleccionados de la fuente de población de los casos | |||||
| 7. Información sobre historial de hábitos alimenticios | |||||
| 8. Información sobre actividad física | |||||
| 9. Información sobre consumo de alcohol/cigarrillo | |||||
| 10. Información sobre uso de medicamentos | |||||
| 11. Información sobre otros factores de riesgo | |||||
| 12. Información sobre la distribución de factores de pronóstico | |||||
| 13. Grupos comparables al inicio del estudio para factores de riesgo relevantes/variables potencialmente confusas | |||||
| 14. Evaluación de la exposición | |||||
| 15. Relación dosis respuesta entre la exposición y el resultado demostrado | |||||
| 16. Evaluación de resultados de estudios ciegos a la exposición | |||||
| 17. Duración apropiada del seguimiento para obtención de resultados | |||||
| 18. Marcadores sustitutos del efecto declarado validado analíticamente | |||||
| 19. Marcadores sustitutos del efecto declarado validado biológicamente | |||||
| 20. Porcentajes y razones de abandono entre grupos similares | |||||
| 21. Ajuste adecuado de los efectos de variables confusas | |||||
| 22. Métodos estadísticos apropiados | |||||
| 23. Relación dosis respuesta entre la exposición y resultados estadísticamente significativos. | |||||
9. Conclusiones del solicitante (máximo 15 renglones)
* * *
1 Estudios en humanos que demuestren la relación entre el consumo del alimento/componente bioactivo y el efecto declarado.
2 Métodos de aleatorización reportados como: al azar, números generados por computador, tablas de números aleatorios o similares.
3 Estudios en humanos que demuestren el mecanismo por el cual el alimento/componente bioactivo puede ser el responsable del efecto (estudios de mecanismo) o estudios de biodisponibilidad.
4 Estudios en animales que demuestren por ejemplo los mecanismos por los cuales el alimento/componente bioactivo puede ser responsable del efecto declarado (estudios de mecanismo), incluyendo estudios de biodisponibilidad.
5 Estos incluyen: estudios in vivo e in vitro basados, tanto en muestras biológicas de animales como de humanos.
6 Estudios que reporten combinación de alguno de los anteriores o de estudios que no estén clasificados anteriormente.
7 Artículos de estudios reportados en humanos que soporten el efecto del alimento/componente bioactivo en la salud, resaltado en la propiedad de salud declarada.
8 Artículos de estudios reportados en humanos con los mecanismos por los cuales el alimento/componente bioactivo, podría ser responsable del resultado en la salud.
9 N/A= No aplicable.
10 Según corresponda placebo disponible
11 Investigadores a cargo de los valores de laboratorio de asignación y de los exámenes complementarios de evaluación (ECG, ultrasonidos, etc.), ciegan a la rama de asignación de sujetos.
1* N/A=No aplica.






