 DATOS
DATOS
 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
 DESCARGAS
DESCARGAS
 DESARROLLOS
DESARROLLOS
 MODIFICACIONES
MODIFICACIONES
 CONCORDANCIAS
CONCORDANCIAS
 NOTIFICACIONES
NOTIFICACIONES
 ACTOS DE TRÁMITE
ACTOS DE TRÁMITE
 ABOGACÍA
ABOGACÍA
 VIDEOS
VIDEOS
CIRCULAR 3 DE 2013
(…)
Diario Oficial No. 48.798 de 22 de mayo de 2013
COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
<Circular derogada por el artículo 28 de la Circular 18 de 2024>
| Fecha: | … |
| Referencia: | por la cual se establece la metodología para la aplicación del régimen de control directo de precios para los medicamentos que se comercialicen en el territorio nacional. |
En ejercicio de sus facultades legales contenidas en el artículo 245 de la Ley 100 de 1993 y en desarrollo de la Ley 1450 de 2011 y,
CONSIDERANDO:
Que el artículo 245 de la Ley 100 de 1993 y el artículo 87 la Ley 1438 de 2011 confirieron a la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos (CNPMDM), la formulación y regulación de la política de precios de medicamentos.
Que el artículo 60 de la Ley 81 de 1988 establece los regímenes de control de precios.
Que la CNPMDM mediante la Circular 02 de 2011, modificó la metodología establecida en la Circular 04 de 2006 fijando nuevos criterios para incorporar los medicamentos a los diferentes regímenes de control de precios.
Que con el fin de precisar algunos aspectos técnicos para la aplicación de la mencionada metodología, la CNPMDM mediante Circular 02 de 2013 modificó la Circular 01 de 2012 ampliando el plazo hasta el 30 de abril de 2013 para el desarrollo de la metodología contemplada en la Circular 02 de 2011.
De acuerdo con lo anterior, la CNPMDM conformó mesas de trabajo con la participación del sector privado y la sociedad civil en las que se discutieron los distintos elementos de la nueva metodología.
Que después de un proceso de consulta pública, la CNPMDM procedió en sesión presencial del 6 de mayo de 2013 a definir la metodología aplicable para el control de precios de medicamentos en Colombia, según lo establece la parte resolutiva de esta circular.
Que el Documento Conpes 155 de 2012 “Política Farmacéutica Nacional”, identificó medicamentos que registran precios en Colombia superiores a los observados en países que la norma nacional había establecido como países de referencia e instruyó a la CNPMDM para desarrollar una política de precios de medicamentos orientada a detectar y resolver las distorsiones del mercado.
Que es objeto de esta política hacer compatibles las necesidades de salud pública con los principios de competencia, comercio y viabilidad de la inversión, producir beneficios que justifiquen sus costos y ser clara, simple y práctica para los usuarios.
En mérito de lo expuesto,
RESUELVE:
OBJETO Y DEFINICIONES INSTRUMENTALES.
ARTÍCULO 1o. OBJETO. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Establecer la metodología para identificar los medicamentos que ingresan al régimen de control directo de precios y determinar su precio máximo de venta.
ARTÍCULO 2o. ETAPAS METODOLÓGICAS. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La metodología establecida en la presente circular consta de cuatro (4) etapas: definición del mercado relevante, medición de su grado de concentración, establecimiento de un precio de referencia y fijación administrativa, cuando corresponda, del precio máximo de venta de los medicamentos.
ARTÍCULO 3o. MERCADO RELEVANTE. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Es un conjunto de medicamentos competidores entre sí y entre los cuales existe sustituibilidad terapéutica y económica. Su identificación tiene el propósito de individualizar cada uno de los medicamentos que lo conforman, identificados con su respectivo Código Único de Medicamentos (CUM). Un mercado relevante puede estar conformado por uno o más medicamentos.
ARTÍCULO 4o. PERÍODO DE REFERENCIA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Los datos utilizados para aplicar la metodología contemplada en la presente circular corresponderán a la información disponible del último año.
ARTÍCULO 5o. GRADO DE CONCENTRACIÓN DEL MERCADO RELEVANTE. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Para la medición del grado de concentración de un mercado relevante, se utilizarán dos medidas:
a) El número de concurrentes y
b) el índice de Herfindahl-Hirschman:
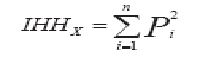
Donde:
| IHHX = | Índice de Herfindahl-Hirschman del mercado relevante “x”. |
| n = | número total de medicamentos en el mercado relevante “x”. |
| i= | número de orden de cada uno de los medicamentos incluidos en el mercado relevante “x”. |
| Pi = | cuota de mercado (en porcentaje) del medicamento “i” en el valor de las ventas totales del mercado relevante. |
Para efectos de la determinación del grado de concentración de un mercado relevante, cuando un mismo actor del mercado controle directa o indirectamente la producción o importación de medicamentos que se identifiquen con diferente CUM, dentro de un mismo mercado relevante, pero que sean de igual principio activo y forma farmacéutica se tratarán como un mismo medicamento, sumando sus respectivas cuotas de mercado y no se considerarán competidores entre sí.
Se entenderá como mercado relevante de elevada concentración aquel cuyo número de concurrentes sea menor o igual a 3 o cuyo IHHX sea superior a 2.500.
ARTÍCULO 6o. PERÍODO DE REGULACIÓN. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos (en adelante la “Comisión”), aplicará esta metodología como mínimo una vez al año.
PARÁGRAFO. A partir de 2014, en la aplicación anual de esta metodología siempre se reconocerá la variación del IPC causada en el año inmediatamente anterior, establecida por el DANE.
ARTÍCULO 7o. PRECIO MÁXIMO DE VENTA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Es el que establece la Comisión para los medicamentos sometidos a régimen de control directo, de acuerdo con la metodología establecida en la presente circular.
ARTÍCULO 8o. PRECIO DE REFERENCIA POR COMPARACIÓN NACIONAL (PRN). <Circular derogada por el artículo 28 de la Circular 18 de 2024> El cálculo del PRN para un mercado relevante se realizará tomando el promedio ponderado, por participación en las ventas totales, medidas en valor, del precio de todos los medicamentos incluidos en el respectivo mercado normalizado por unidad mínima de concentración. Tal promedio constituirá el precio de referencia para el respectivo mercado relevante.
Este cálculo se hará utilizando precios observados en un mismo nivel de la cadena de suministro y canal. Se excluirán del cálculo aquellas observaciones que correspondan a extremos atípicos.
ARTÍCULO 9o. PRECIO DE REFERENCIA POR COMPARACIÓN INTERNACIONAL (PRI). <Circular derogada por el artículo 28 de la Circular 18 de 2024> El cálculo del PRI para un mercado relevante o un subconjunto del mismo se establecerá así:
a) En cada país de referencia, se obtendrá el promedio simple de los precios, normalizados por unidad mínima de concentración, de los medicamentos del mercado relevante o de un subconjunto del mismo;
b) Se ordenarán los promedios así obtenidos de mayor a menor y se eliminarán aquellas observaciones que correspondan a extremos atípicos;
c) El percentil veinticinco (25) será el PRI.
Este cálculo se hará utilizando precios observados en un mismo nivel de la cadena de suministro y canal.
ARTÍCULO 10. PAÍSES DE REFERENCIA INTERNACIONAL. <Circular derogada por el artículo 28 de la Circular 18 de 2024> De acuerdo con criterios de integración comercial, proximidad geográfica con Colombia, similitud en el grado de intervención económica general, pertenencia a la OECD y disponibilidad de información, los países de referencia serán Argentina, Brasil, Chile, Ecuador, México, Panamá, Perú, Uruguay, España, Estados Unidos, Reino Unido, Australia, Canadá, Francia, Noruega, Alemania y Portugal. El PRI se calculará tomando la información de todos estos países, cuando esté disponible. En caso de no estarlo, sólo serán países de referencia aquellos de la lista sobre los que exista información.
ARTÍCULO 11. FACTORES DE AJUSTE. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Si la información sobre precios de la que dispone la Comisión para aplicar la presente metodología se refiere a un punto de la cadena de suministro distinto al punto de la cadena regulado, se utilizarán factores de ajuste para hacerlos comparables en ese mismo punto de la cadena. Los factores de ajuste utilizados se harán públicos, junto con la metodología utilizada para establecerlos y se determinarán con arreglo a cualquiera de los siguientes procedimientos:
a) Determinando el promedio simple de factores de ajuste observados para un mismo medicamento en los distintos países de referencia;
b) Calculando, a partir de la información nacional disponible, factores de ajuste promedio en grandes grupos de medicamentos cuyas características logísticas y relación precio/volumen sean comunes.
ARTÍCULO 12. TASA DE CAMBIO. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La comparación de precios se hará teniendo como base los precios en moneda local de cada país de referencia y la tasa de cambio nominal promedio de cada país, expresada en dólares de los Estados Unidos de América, para el Período de Referencia.
ARTÍCULO 13. FUENTES DE INFORMACIÓN. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La Comisión podrá utilizar cualquier fuente de información que considere idónea y pertinente e informará públicamente cuál es la fuente utilizada.
La Comisión hará pública la información utilizada, guardando su confidencialidad cuando cumpla con los requisitos exigidos por la legislación vigente para obtener dicho trato.
ARTÍCULO 14. NIVEL MAYORISTA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Es el nivel de la cadena de suministro donde se venden medicamentos a farmacias-droguerías o droguerías, o a un Comprador Institucional.
ARTÍCULO 15. COMPRADOR INSTITUCIONAL. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Son aquellos que compran medicamentos con recursos públicos, incluye los compradores de los regímenes especiales.
MODALIDADES DE CONTROL DE PRECIOS Y MODELO DE REGULACIÓN.
ARTÍCULO 16. MODALIDADES DE CONTROL. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Todos los medicamentos comercializados en el país estarán sujetos a control, bajo una de las siguientes modalidades:
a) Régimen de Libertad Vigilada, en el cual quienes vendan medicamentos en razón de su actividad empresarial podrán determinar libremente su precio, bajo la única obligación de informar sobre sus operaciones comerciales, de acuerdo con la normativa vigente;
b) Régimen de Control Directo, en el cual la Comisión fijará el precio máximo de venta, en uno o más niveles de la cadena de comercialización, para un determinado período de tiempo. Los medicamentos que se encuentren en control directo también estarán sujetos a la obligación de informar sobre sus operaciones comerciales, de acuerdo con la normativa vigente.
ARTÍCULO 17. MEDICAMENTOS SOMETIDOS AL RÉGIMEN DE LIBERTAD VIGILADA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Todos los medicamentos que se comercializan a nivel nacional, se asumen incorporados en el régimen de libertad vigilada, con excepción de aquellos que ingresen al régimen de control directo de conformidad con lo establecido en la presente circular.
ARTÍCULO 18. MEDICAMENTOS SOMETIDOS AL RÉGIMEN DE CONTROL DIRECTO. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Se incorporarán al régimen de control directo aquellos medicamentos de los mercados relevantes de elevada concentración, cuyo precio de venta observado en el mercado nacional durante el período de referencia, en la respectiva presentación comercial, se encuentre por encima del PRI, según sea el caso, de acuerdo con lo establecido en el artículo 19.
ARTÍCULO 19. MODALIDADES PARA ESTABLECER EL PRECIO MÁXIMO DE VENTA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Según el carácter de elevada concentración del respectivo mercado relevante fuese determinado por el número de concurrentes o el IHHx, el Precio Máximo de Venta se determinará así:
a) Mercados relevantes con tres o menos competidores: Para aquellos medicamentos que conforman mercados relevantes con tres o menos competidores y cuyo precio promedio de venta en el mercado nacional durante el Periodo de Referencia sea mayor al PRI, el Precio Máximo de Venta equivaldrá al PRI;
b) Mercados relevantes con más de tres concurrentes e IHHx superior a 2.500: Para aquellos medicamentos de mercados relevantes de más de tres concurrentes y cuyo IHHx sea superior a 2.500, se establecerán precios de referencia y Precios Máximos de Venta diferenciados para dos subgrupos de medicamentos. Se ordenarán los medicamentos según su participación en las ventas totales en el mercado relevante y posteriormente se seguirá el siguiente procedimiento:
i) Aquellos medicamentos de mayor participación y cuyo precio promedio de venta en el mercado nacional durante el Periodo de Referencia sea mayor al PRI de este subconjunto de medicamentos, su Precio Máximo de Venta será tal PRI;
ii) Los demás medicamentos del mercado relevante serán monitoreados con respecto al comportamiento de su precio durante el Período de Referencia. En caso de observarse incrementos superiores a la variación del IPC, serán sometidos a control directo si dicho incremento es injustificado. En ese caso, el Precio Máximo de Venta será el PRI o una fracción del mismo. El titular podrá presentar a la Comisión la argumentación que considere pertinente para demostrar que el incremento por encima del IPC está justificado.
ARTÍCULO 20. PUNTO DE LA CADENA DE SUMINISTRO REGULADO. <Circular derogada por el artículo 28 de la Circular 18 de 2024> El Precio Máximo de Venta se establecerá en el nivel mayorista. En las operaciones de ventas de medicamentos a las farmacias-droguerías o droguerías, el Precio Máximo de Venta podrá ser incrementado en el valor correspondiente a los costos logísticos asociados a la distribución entre Bogotá y el punto de venta al público.
PARÁGRAFO 1o. Para los medicamentos sometidos a control directo, el valor para el reconocimiento y pago de medicamentos no incluidos en los planes de beneficio, así como el precio a ser computado para el cálculo de la Unidad de Pago por Capitación (UPC), será el Precio Máximo de Venta.
PARÁGRAFO 2o. De manera excepcional y motivada, la Comisión podrá fijar Precios Máximos de Venta en cualquier otro eslabón de la cadena de suministro cuando sus respectivos márgenes de comercialización registren distorsiones significativas.
ARTÍCULO 21. EXCEPCIÓN AL PROCEDIMIENTO. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Con independencia del grado de concentración de su correspondiente mercado relevante la Comisión podrá incorporar un medicamento al régimen de control directo en alguna de las siguientes circunstancias y en cualquier momento:
a) Cuando registre alto impacto sobre la sostenibilidad del Sistema General de Seguridad Social en Salud o sea de interés en Salud Pública;
b) Cuando registre incrementos injustificados en su precio, por encima de la inflación global del año anterior;
c) Cuando el PRN en un mercado relevante sea significativamente superior al respectivo PRI.
En estos casos, la Comisión determinará su precio de referencia de acuerdo a lo establecido en la presente circular y fijará su Precio Máximo de Venta como una fracción del precio de referencia.
MERCADOS RELEVANTES.
ARTÍCULO 22. DETERMINACIÓN DE LOS MERCADOS RELEVANTES. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La Comisión determinará, para cada medicamento comercializado en el país, el mercado relevante al cual pertenece, según la modalidad en la que se manifieste la sustitución terapéutica y económica. En el caso de los medicamentos que se venden bajo fórmula médica, conformarán un mercado relevante los medicamentos con igual ATC5 e igual forma farmacéutica (ATC5 FF). En el caso de los medicamentos de venta libre (OTC), conformarán un mercado relevante los medicamentos con igual ATC3 e igual forma farmacéutica (ATC3 FF).
ARTÍCULO 23. EXCEPCIONES PARA LA CONFORMACIÓN DE MERCADOS RELEVANTES DE LOS MEDICAMENTOS VENDIDOS BAJO FÓRMULA MÉDICA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> En la conformación de los mercados relevantes de los medicamentos vendidos bajo fórmula médica, la Comisión utilizará como regla general el ATC5 FF. Sin embargo, de manera excepcional y justificada, podrá tomar en cuenta las siguientes consideraciones para la conformación de dichos mercados:
a) Podrán pertenecer a un mismo mercado relevante, medicamentos de diferentes ATC5-FF para los que haya evidencia científica de sustitución terapéutica y evidencia práctica de sustitución económica;
b) Podrán pertenecer a mercados relevantes distintos, medicamentos que siendo de igual ATC5-FF, no pueden ser considerados en conjunto como sustitutos entre sí, porque la práctica clínica y la evidencia científica poscomercialización sugieren restricciones de sustitución debido a sus características farmacocinéticas. Los mercados relevantes de este grupo se estructurarán en segmentos de medicamentos entre los cuales haya evidencia de sustituibilidad;
c) Podrán pertenecer a mercados relevantes distintos, medicamentos que siendo de igual ATC5-FF y sustitutos terapéuticos entre sí, tengan particulares formas farmacéuticas y/o sistemas de administración que representan un aporte terapéutico en términos de costo-efectividad y/o bienestar para el paciente, que ameriten diferenciarlos de los demás medicamentos sustitutos del mismo ATC5-FF.
La evidencia científica utilizada para justificar la conformación de mercados relevantes y sus excepciones, deberá ser objetivamente valorada, mediante metodologías estandarizadas.
DISPOSICIONES FINALES.
ARTÍCULO 24. MEDICAMENTOS NUEVOS. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Cuando un laboratorio productor o su importador se dispongan a comercializar un medicamento nuevo, deberá reportar a la Secretaría Técnica de la Comisión la información propia necesaria para la aplicación de esta circular, en el formato que para el efecto se determine.
ARTÍCULO 25. SANCIONES POR EL INCUMPLIMIENTO DE LAS OBLIGACIONES DE REPORTAR. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La inobservancia de las disposiciones sobre los reportes de precios de medicamentos y de Precio Máximo de Venta, constituyen una violación de las disposiciones sobre protección al consumidor en materia de precios y su incumplimiento estará sujeto a las multas y demás sanciones administrativas contempladas en el artículo 132 de la Ley 1438 de 2011.
ARTÍCULO 26. SOLICITUD DE INFORMACIÓN. <Circular derogada por el artículo 28 de la Circular 18 de 2024> La Secretaría Técnica de la Comisión podrá solicitar a cualquier miembro de la cadena de distribución, información necesaria para las labores de control y vigilancia de precios de medicamentos.
ARTÍCULO 27. VIGENCIA DE LOS PRECIOS MÁXIMO DE VENTA. <Circular derogada por el artículo 28 de la Circular 18 de 2024> Los Precios Máximos de Venta que se establezcan con arreglo a la metodología de la presente circular, serán publicados en el mes de octubre de cada año y comenzarán a regir a partir del primero de enero del año siguiente. No obstante, la Comisión podrá intervenir en cualquier momento en razón de lo indicado en el artículo 21, otorgando un plazo razonable para la vigencia del Precio Máximo de Venta fijado.
PARÁGRAFO TRANSITORIO. Durante el proceso regulatorio del presente año, la entrada en vigencia de los Precios Máximos de Venta ocurrirá a los quince días hábiles posteriores a su expedición.
ARTÍCULO 28. VIGENCIA Y DEROGATORIA. La presente circular rige a partir de su publicación en el Diario Oficial y deroga todas las disposiciones que le sean contrarias.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 21 de mayo de 2013.
La Delegada del Presidente de la República,
CATALINA CRANE ARANGO.
El Ministro de Salud y Protección Social,
ALEJANDRO GAVIRIA URIBE.
El Ministro de Comercio, Industria y Turismo,
SERGIO DÍAZ-GRANADOS GUIDA.






