 DATOS
DATOS
 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
 DESCARGAS
DESCARGAS
 DESARROLLOS
DESARROLLOS
 MODIFICACIONES
MODIFICACIONES
 CONCORDANCIAS
CONCORDANCIAS
 NOTIFICACIONES
NOTIFICACIONES
 ACTOS DE TRÁMITE
ACTOS DE TRÁMITE
 ABOGACÍA
ABOGACÍA
 VIDEOS
VIDEOS
CIRCULAR 1 DE 2015
(febrero 2)
Diario Oficial No. 49.415 de 4 de febrero de 2015
COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
<NOTA DE VIGENCIA: Circular derogada, a partir del 1 de octubre de 2022, salvo el anexo sustituido por la Circular 2 de 2017 el cual quedará derogado a partir del 1 de julio de 2023, por la Circular 14 de 2022>
Por la cual se interviene en los mercados de dispositivos médicos, se establece un régimen de libertad vigilada para estos productos y se someten unos estents coronarios a control directo.
LA COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS,
en ejercicio de sus facultades legales contenidas en el artículo 245 de la Ley 100 de 1993, el artículo 87 de la Ley 1438 de 2011, y
1
CONSIDERANDO:
Que el artículo 60 de la Ley de 81 de 1988 establece los regímenes de control de precios.
Que el artículo 87 de la Ley 1438 de 2011 declaró que la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos –la Comisión– tendrá a su cargo la formulación y la regulación de la política de precios de medicamentos y dispositivos médicos.
Que el artículo 90 de la Ley 1438 de 2011 estableció que el Gobierno nacional en aras de garantizar la competencia efectiva para la producción, venta, comercialización y distribución de medicamentos, insumos y dispositivos médicos, podrá adelantar las gestiones necesarias para que la población disponga de medicamentos, insumos y dispositivos médicos de buena calidad a precios accesibles.
Que la diversidad del mercado de dispositivos médicos, las deficiencias de información de precios y la complejidad de su caracterización sugieren un abordaje inductivo, más que establecer una metodología general y única para la regulación de precios de todos los dispositivos médicos.
Que los dispositivos endovasculares coronarios, en especial, los estents coronarios, se seleccionaron como piloto para el inicio del proceso de regulación de precios de dispositivos médicos en tanto cumplen con los siguientes criterios de priorización:
1. Constituyen un grupo de productos acotado.
2. Su descripción y clasificación se encuentran estandarizadas internacionalmente.
3. Existe información de precios nacionales disponible, tanto de recobros como de gasto del Plan Obligatorio de Salud (POS).
4. Representan una importante porción del gasto del Sistema General de Seguridad Social en Salud (SGSSS), y
5. Que las enfermedades coronarias son una de las prioridades identificadas en el plan decenal de salud.
Que en el Grupo Técnico Asesor (GTA) de la Comisión, dispuso para consulta pública la información utilizada para analizar el mercado dispositivos endovasculares coronarios y tomar las decisiones de la presente circular, con el fin de que los interesados pudieran hacer los comentarios y las solicitudes que consideraran pertinentes.
Que los soportes técnicos y bases de datos utilizadas que sirvieron para el cálculo del precio máximo de venta, señalado en el artículo 20 de esta circular, se encuentran disponibles en las páginas web de los Ministerios de Salud y Protección Social y de Comercio, Industria y Turismo.
Que la Comisión analizó todos los comentarios y solicitudes recibidas y, posteriormente, tomó las decisiones que se reflejan en la presente circular.
Que motivada por el principio de transparencia que rige las actuaciones de la Comisión, las solicitudes se encuentran publicadas en las páginas web anteriormente mencionadas.
Que mediante oficio 14-284128-2-0 del 16 de enero de 2015 la Superintendencia de Industria y Comercio rindió concepto de abogacía de la competencia frente al proyecto de regulación, y encontró “(…) justificada la decisión de política pública de controlar el precio de los estents coronarios medicados (…)”.
Que analizados dos de los mercados relevantes de los estents coronarios se encuentra que: (i) hay un índice de concentración Herfindal – Hirschman superior a 2.500, lo que indica que este es un mercado altamente concentrado, y (ii) se observa que el precio del mercado nacional es superior en algunos casos al de los otros países.
Que el documento que contiene el análisis técnico de los mercados, los datos utilizados, la aplicación de los parámetros estadísticos aplicados a los datos nacionales, y otros detalles técnicos relevantes se encuentra disponible en la página web del Ministerio de Salud y Protección Social y del Ministerio de Comercio, Industria y Turismo.
Que se encontró que los competidores con mayor participación de mercado son lo que fijan los precios más altos.
Que la referenciación internacional es el mecanismo más idóneo para identificar si el nivel de precios del mercado nacional requiere una intervención de precios.
Que es necesario obtener mayor información del mercado para reducir las asimetrías de información, objetivo importante para una mejor intervención por parte de la Comisión.
Que en el conjunto de estents coronarios, la Comisión ha identificado que la cadena de comercialización es corta, es decir, que el laboratorio productor o importador es quien comercializa directamente a la IPS y, por tanto, este hecho es relevante para determinar el factor de ajuste.
Que el consumo de estos dispositivos está asociado directamente al procedimiento de angioplastia, lo que implica un importante impacto sobre gasto del SGSSS.
En mérito de lo expuesto,
RESUELVE:
OBJETO Y DEFINICIONES.
ARTÍCULO 1o. OBJETO. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Establecer la metodología general de análisis de los mercados de dispositivos médicos para fines de la intervención por parte de la Comisión en dichos mercados; establecer un régimen de libertad vigilada para dispositivos endovasculares coronarios que se comercialicen en el territorio nacional y aplicar la metodología para someter unos estents coronarios a control directo.
ARTÍCULO 2o. CONJUNTO DE PRODUCTOS RELEVANTES PARA LA REGULACIÓN DE PRECIOS POR SU SUSTITUIBILIDAD TERAPÉUTICA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Corresponde al conjunto de dispositivos médicos para los que se reconoce sustituibilidad terapéutica, considerando la evidencia científica disponible. Estos pueden corresponder a más de un mercado relevante por existir evidencia de baja sustituibilidad económica entre subconjuntos de estos dispositivos.
ARTÍCULO 3o. MERCADO RELEVANTE PARA EFECTOS DE REGULACIÓN DE PRECIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Corresponde a un grupo de dispositivos médicos para los cuales existe evidencia científica sobre similitud en las características del producto y su sustituibilidad terapéutica e información de precios de que no existen diferencias significativas asociadas a las características terapéuticas del producto. Para la conformación de estos mercados relevantes las diferencias en precios producto de las asociaciones de marca no serán un criterio relevante para el análisis de sustitución económica, ni de segmentación adicional.
ARTÍCULO 4o. TEMPORALIDAD DE LOS DATOS DE PRECIOS A OBSERVAR. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Los precios, tanto nacionales como internacionales, utilizados para el análisis de los diferentes mercados de dispositivos médicos serán aquellos correspondientes a la información más reciente disponible en las bases de datos consultadas.
ARTÍCULO 5o. FUENTES DE INFORMACIÓN. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> La Comisión iniciará la inclusión sistemática de los dispositivos médicos al Régimen de Libertad Vigilada. Adicionalmente y durante la implementación de este régimen utilizará las fuentes de información, disponibles e idóneas. La Comisión hará pública la información utilizada siempre que esta no cumpla con los requisitos exigidos por la legislación vigente para ser considerada como confidencial. La Comisión preferirá el uso de información pública, de libre acceso y siempre revelará la fuente de información.
ARTÍCULO 6o. PAÍSES DE REFERENCIA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Son los países cuyas fuentes de información se utilizan para construir el Precio de Referencia Internacional. Estos países serán seleccionados con criterios de integración comercial, proximidad geográfica con Colombia, similitud en el grado de intervención económica general, pertenencia a la OECD y disponibilidad de información.
ARTÍCULO 7o. PRECIO DE REFERENCIA NACIONAL (PRN). <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Corresponde al precio calculado para un mercado relevante a partir del análisis estadístico de la información disponible de precios nacionales. El Análisis estadístico se definirá, a partir de medidas de tipo paramétrico y no paramétrico, del comportamiento de los datos y del mejor estadístico a usar para caracterizar el mercado nacional.
ARTÍCULO 8o. PRECIO DE REFERENCIA INTERNACIONAL (PRI). <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Corresponde al precio calculado para un mercado relevante a partir del análisis de la información de precios internacionales disponibles.
La tasa de cambio a utilizar será la oficial del Banco de la República, tomando el promedio del año corrido inmediatamente anterior al momento de regulación.
ARTÍCULO 9o. PUNTO DE LA CADENA REGULADO. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Es el punto de la cadena de suministro en la que se fija el precio máximo de venta.
ARTÍCULO 10. FACTOR DE AJUSTE. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Si la información sobre precios de la que dispone la Comisión se refiere a un punto de la cadena de suministro distinto al punto de la cadena regulado, se utilizarán factores de ajuste para hacerlos comparables en el mismo punto de la cadena.
ARTÍCULO 11. PRECIO MÁXIMO DE VENTA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Es el precio que establece la CNPMDM para los dispositivos sometidos a control de precios en el régimen de control directo.
PARÁMETROS GENERALES DE ANÁLISIS DE LOS MERCADOS DE DISPOSITIVOS MÉDICOS.
ARTÍCULO 12. ETAPAS DE ANÁLISIS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> La metodología de regulación de precios para los dispositivos médicos consta de las siguientes etapas:
a) Definición del conjunto de productos relevantes para la regulación de precios por su sustituibilidad terapéutica.
b) Análisis de los mercados relevantes para efectos regulatorios.
c) Análisis a nivel nacional de los mercados relevantes. Una vez obtenido el PRN, se procederá a analizar el mercado nacional, para lo cual se podrán considerar, entre otros, los siguientes criterios:
i. El total de concurrentes y la concentración de mercado.
ii. La distribución de los precios.
iii. La pertenencia o no al POS.
iv. El análisis de oferta y demanda (frecuencia de uso o datos epidemiológicos).
v. Asimetrías de información.
d) Análisis y comparación con los precios internacionales, lo cual puede hacer referencia a:
i. La comparación directa entre los precios nacionales con los precios observados en los países de referencia. Dicha comparación se realizará con los precios considerados en el mismo punto de la cadena, para lo cual se podrán aplicar los factores de ajuste pertinentes.
ii. La comparación entre el PRN y el PRI (una vez calculado el PRI) para cada mercado relevante de estents coronarios.
e) Definición de una metodología puntual para los mercados relevantes analizados.
Una vez agotadas las etapas de análisis y surtido el proceso de consulta pública, la Comisión definirá la modalidad de regulación de precios a las que quedarán sometidos los dispositivos que componen el mercado relevante.
APLICACIÓN DE LOS PARÁMETROS DE ANÁLISIS LOS “DISPOSITIVOS ENDOVASCULARES CORONARIOS”.
ARTÍCULO 13. DETERMINACIÓN CONJUNTO DE PRODUCTOS RELEVANTES PARA LA REGULACIÓN DE PRECIOS POR SU SUSTITUIBILIDAD TERAPÉUTICA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Para efectos de la presente circular, se define como un conjunto de productos relevantes para la regulación de precios por su sustituibilidad terapéutica el conjunto de dispositivos endovasculares coronarios.
PARÁGRAFO. Soporte técnico. Una vez la Comisión seleccionó este conjunto de productos como relevantes para evaluar la necesidad o no, la necesidad de intervención realizó un estudio.
ARTÍCULO 14. CONJUNTO DE DISPOSITIVOS ENDOVASCULARES CORONARIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El conjunto de dispositivos endovasculares coronarios se clasifica de la siguiente manera:
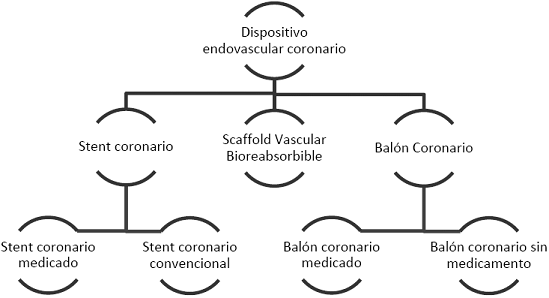
ARTÍCULO 15. MERCADOS RELEVANTES OBJETO DE ANÁLISIS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El objeto de la presente regulación son los “estents coronarios”, el cual a su vez se divide en dos mercados relevantes:
1. “Estent coronario convencional”, y
2. “Estent coronario medicado”.
ARTÍCULO 16. ESTENT CORONARIO CONVENCIONAL. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Dispositivo endovascular coronario implantable de forma permanente, cuyo fin es mejorar el espacio luminal del vaso sin liberar medicamento alguno.
ARTÍCULO 17. ESTENT CORONARIO MEDICADO. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Dispositivo endovascular coronario implantable de forma permanente, cuyo fin es mejorar el espacio luminal del vaso liberando algún medicamento.
ARTÍCULO 18. PUNTO DE LA CADENA REGULADO. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El precio se regula a nivel de prestadores. Esto implica que el precio de regulación corresponde al precio máximo de venta que se puede cobrar en cualquier transacción a lo largo de la cadena. Los prestadores no podrán aumentar al precio regulado ningún porcentaje en sus transacciones con los proveedores y/o los pagadores. El precio regulado corresponde también al valor máximo de recobro al Fondo de Solidaridad y Garantía (Fosyga).
ARTÍCULO 19. PAÍSES DE REFERENCIA PARA LOS ESTENTS CORONARIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Los países de referencia para el cálculo del PRI de los estents coronarios serán Alemania, Australia, Brasil, Canadá, Chile, España, Estados Unidos, Francia, Italia, México, Panamá, Portugal, Reino Unido y Uruguay.
ARTÍCULO 20. FACTOR DE AJUSTE PARA LOS ESTENTS CORONARIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> A los precios obtenidos de bases de datos de países de referencia que tengan información de precios en el punto ex fábrica, se aplicará un factor de ajuste del 9%, para hacerlos comparables con el punto de cadena regulado.
ARTÍCULO 21. PRECIO DE REFERENCIA NACIONAL PARA LOS MERCADOS RELEVANTES DE LOS ESTENTS CORONARIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El Precio de Referencia Nacional (PRN), para cada uno de los estents coronarios corresponde al percentil 50 de la muestra de datos nacionales utilizados.
Los valores que corresponden son los siguientes:
| Tipo de Estent | PRN |
| Estent convencional | $ 1.701.000,00 |
| Estent medicado | $5.000.000,00 |
ARTÍCULO 22. PRECIO DE REFERENCIA INTERNACIONAL PARA LOS ESTENTS CORONARIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El Precio de Referencia Internacional (PRI), para los estents coronarios corresponde al percentil 25 de la muestra de precios de los países de referencia.
Los valores que corresponden son los siguientes:
| Tipo de estent | PRI |
| Estent convencional | $ 1.440.000 |
| Estent medicado | $ 3.227.000 |
ARTÍCULO 23. ESTENTS CORONARIOS SOMETIDOS AL RÉGIMEN DE CONTROL DIRECTO. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Se incorporarán al régimen de control directo todos los estents coronarios medicados que se comercializan a nivel nacional.
ARTÍCULO 24. PRECIO MÁXIMO DE VENTA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> <Ver ajuste de precio de Notas de Vigencia> De conformidad con los artículos anteriores, se establece como Precio Máximo de Venta en el punto de la cadena regulado para los estents coronarios medicados que se comercialicen en el país el valor de tres millones doscientos veintisiete mil pesos colombianos ($3.227.000.00)*.
El Precio Máximo de Venta incluye el margen asociado a la distribución y cualquier otro costo logístico en que incurra el prestador.
Para los dispositivos sometidos al Régimen de Control Directo, el valor máximo para el reconocimiento y pago de estents coronarios a través del Fondo de Solidaridad y Garantía (Fosyga) seráì el Precio Máximo de Venta.
RÉGIMEN DE LIBERTAD VIGILADA Y DISPOSICIONES FINALES.
ARTÍCULO 25. DISPOSITIVOS ENDOVASCULARES CORONARIOS SOMETIDOS AL RÉGIMEN DE LIBERTAD VIGILADA. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Todos los dispositivos endovasculares coronarios que se comercializan a nivel nacional, se encuentran incorporados en el régimen de libertad vigilada.
El Ministerio de Salud y Protección Social desarrollará un sistema de información de precios de venta de dispositivos endovasculares coronarios que se alimentará con el reporte obligatorio que deberán realizar los actores de la cadena de dispositivos endovasculares coronarios. La omisión, renuencia o inexactitud en el reporte acarreará sanciones, según lo establece el artículo 132 de la Ley 1438 de 2011.
ARTÍCULO 26. RESPONSABLES DEL REPORTE. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Todo fabricante, importador o comercializador de dispositivos endovasculares coronarios deberá cumplir con la obligación de reporte de conformidad con el anexo 1 de la presente circular.
PARÁGRAFO. REPORTE EN CEROS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> Todo fabricante, importador o comercializador de dispositivos endovasculares coronarios que tenga registro sanitario y no realice ventas durante el periodo de reporte deberá en todo caso realizar el reporte en ceros.
ARTÍCULO 27. PERIODO DE REPORTE. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> El reporte de información se deberá realizar trimestralmente para información mensual, a menos que la Comisión establezca una periodicidad distinta así:
| Fecha máxima de reporte | Meses que deben reportarse |
| Último día hábil del mes de abril | Enero, febrero y marzo del respectivo año |
| Último día hábil del mes de julio | Abril, mayo y junio del respectivo año |
| Último día hábil del mes de octubre | Julio, agosto y septiembre del respectivo año |
| Febrero 15 de cada año* | Octubre, noviembre y diciembre del respectivo año |
*En caso de que este corresponda a un día que no es hábil, el plazo se vencerá al día hábil siguiente.
PARÁGRAFO. REPORTE HISTÓRICO. <Parágrafo modificado por el artículo 1 de la Circular 2 de 2015. El nuevo texto es el siguiente:> El primer reporte que corresponderá a la información histórica mensual para el segundo semestre de 2014 deberá reportarse a más tardar el 30 de abril de 2015.
ARTÍCULO 28. SANCIONES POR EL INCUMPLIMIENTO DEL RÉGIMEN DE CONTROL DE PRECIOS. <Artículo derogado, a partir del 1 de octubre de 2022, por la Circular 14 de 2022> La inobservancia de los precios regulados o de la obligación de reporte estará sujeta a las sanciones contempladas en el artículo 132 de la Ley 1438 de 2011.
ARTÍCULO 29. VIGENCIA Y DEROGATORIA. La presente circular empezará a regir un mes calendario después de su publicación en el Diario Oficial y deroga todas las disposiciones que le sean contrarias.
Publíquese y cúmplase.
Dada en Bogotá, D.C., a 2 de febrero de 2015.
La Delegada del Presidente de la República,
AURA MARÍA LONDOÑO SÁNCHEZ.
El Ministro de Salud y Protección Social,
ALEJANDRO GAVIRIA URIBE.
La Ministra de Comercio, Industria y Turismo,
CECILIA ÁLVAREZ–CORREA GLEN.
ESPECIFICACIONES DEL ARCHIVO DE REPORTE DE PRECIOS DE VENTA DE DISPOSITIVOS MÉDICOS INCORPORADOS AL RÉGIMEN DE LIBERTAD VIGILADA.
<Anexo derogado, a partir del 1 de julio de 2023, por la Circular 14 de 2022>
<Anexo sustituido por la Circular 2 de 2017. El nuevo texto es el siguiente:>
Las entidades obligadas a reportar definidas en la presente circular deben enviar al Ministerio de Salud y Protección Social los archivos planos con la información de los precios de venta de dispositivos médicos. Para este anexo técnico se definen cuatro capítulos:
1. ESTRUCTURA Y ESPECIFICACIÓN DE LOS ARCHIVOS
2. CARACTERÍSTICAS DE LOS ARCHIVOS PLANOS
3. PLATAFORMA PARA EL ENVÍO DE ARCHIVOS
4. PERIODO DE REPORTE Y PLAZO
1. ESTRUCTURA Y ESPECIFICACIÓN DE LOS ARCHIVOS.
a) Estándar del archivo de reporte
El nombre de los archivos con la información de los precios de venta de dispositivos médicos, debe cumplir con el siguiente estándar:
| Componente del nombre de archivo | Valores permitidos o formato | Descripción | Longitud fija | Requerido |
| Módulo de información | DIS | Identificador del módulo de información | 3 | SÍ |
| Tipo de fuente | 113 | Fuente de la nformación de los obligados a reportar | 3 | SÍ |
| Tema de información | DVEN | Información de precios de dispositivos médicos | 4 | SÍ |
| Fecha de corte | AAAAMMDD | Fecha de corte de la información reportada. Es el último día calendario del período de información reportada. No se debe utilizar ningún tipo de separador. Ejemplo de fecha válida: 20160331. | 8 | SÍ |
| Tipo de identificación de la entidad que reporta | NI | Tipo de identificación de la entidad que reporta la información. | 2 | SÍ |
| Número de identificación de la entidad que reporta | 999999999999 | Número de identificación de la entidad que envía los archivos, de acuerdo con el tipo de identificación del campo anterior: Número de NIT sin incluir el dígito de verificación para tipo de identificación NI. Se debe usar el carácter CERO de relleno a la izquierda si es necesario para completar el tamaño del campo. Ejemplo: 000860999123 | 12 | SÍ |
| Extensión del archivo | .TXT | Extensión del archivo plano. Si es un archivo plano .txt. | 4 | SÍ |
b) Nombre del archivo de reporte
| Tipo de archivo | Nombre de archivo | Longitud |
| Reporte de información de precios de dispositivos médicos | DIS113DVENAAAAMMDDNI999999999999.TXT | 36 |
c) Contenido del archivo
El archivo de la información de precios de dispositivos médicos compuesto por un único registro de control (Registro Tipo 1) utilizado para identificar la entidad fuente de la información y varios tipos de registros de detalle numerados a partir del Registro Tipo 2 que contienen la información solicitada así:
| Registro | Descripción | Reporte |
| Tipo 1 | Registro de control | Obligatorio |
| Tipo 2 | Registro de detalle de precios de venta de dispositivos médicos | Obligatorio |
Cada registro está conformado por campos, los cuales van separados por pipes.
c.1. Registro tipo 1 – registro de control
Es obligatorio. Es el primer registro que debe aparecer en los archivos que sean enviados.
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 0 | Tipo de registro | 1 | N | 1: valor que significa que el registro es de control | SÍ |
| 1 | Tipo de Identificación de la entidad que reporta | 2 | A | El tipo de identificación es NI (NIT) | SÍ |
| 2 | Número de identificación de la entidad que reporta | 12 | N | Número de identificación de la entidad que envía los archivos, de acuerdo con el tipo de identificación del campo anterior. Número de NIT sin incluir el dígito de verificación para tipo de identificación NI. | SÍ |
| 3 | Fecha inicial del periodo de la información reportada | 10 | F | En formato AAAA-MM-DD. Debe corresponder a la fecha de inicio del período de información reportada. Ejemplo de fecha válida: 2017-01-01 | SÍ |
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 4 | Fecha final del periodo de la información reportada | 10 | F | En formato AAAA-MM-DD. Debe corresponder a la fecha final del periodo de información reportada y debe concordar con la fecha de corte del nombre del archivo. Último día calendario del mes o periodo que se está reportando. Ejemplo de fecha válida: 2017-03-31 | SÍ |
| 5 | Número total de registros de detalle contenidos en el archivo | 10 | N | Debe corresponder a la cantidad de registros tipo 2, contenidos en el archivo. | SÍ |
c.2. Registro tipo 2 – registro de detalle de precios de ventas de dispositivos médicos
Mediante el Registro Tipo 2, las entidades reportan el detalle de la información ventas de dispositivos médicos.
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 0 | Tipo de registro | 1 | N | 2: Valor que significa que el registro es de detalle | SÍ |
| 1 | Consecutivo de registro | 10 | N | Número consecutivo de registros de detalles dentro del archivo. Inicia en 1 para el primer registro de detalle y va incrementando de 1 en 1 hasta el final del archivo. | SÍ |
| 2 | Mes de reporte | 2 | F | Corresponde al mes en el cual se efectuaron las ventas del dispositivo, el cual debe pertenecer al trimestre que se está reportando. Debe corresponder a un mes válido en dos dígitos. Ejemplo 01 (enero), 10 (octubre). | SÍ |
| 3 | Canal | 3 | A | Dato usado para discriminar las ventas de los mecanismos por canal de distribución institucional y comercial. Los valores permitidos son: INS: institucional COM: comercial. (Ver la tabla de referencia SISMED Canal en web.sispro.gov.co donde encontrará los valores permitidos, modificados, adicionados o que sustituyan los mencionados en este campo) | SÍ |
| 4 | Identificación del dispositivo médico | 19 | A | Debe reportarse el número de expediente asignado por el Invima y número de consecutivo del dispositivo médico, el cual hace referencia a la unidad de dispensación. El número de expediente es un valor numérico con longitud máxima de quince dígitos y el consecutivo es máximo de tres dígitos. Estos dos códigos deben ser separados por el signo “-“. Ejemplo: 19955791-1 Ver la tabla de referencia Dispositivos_MedicosLibertadVigilada en la web sispro.gov.co donde encontrará los valores permitidos, modificados, adicionados o que sustituyan los mencionados en este campo. | SÍ |
| 5 | Precio unitario mínimo de venta | 14 | D | Precio unitario mínimo al cual se vendió una unidad de dispensación del dispositivo en el mes y canal reportado. El campo permite hasta dos cifras decimales separados con separador decimal de punto (.). | SÍ |
| 6 | Precio unitario máximo de venta | 14 | D | Precio unitario máximo al cual se vendió una unidad de dispensación del dispositivo en el mes y canal reportado. El campo permite hasta dos cifras decimales separados con separador decimal de punto (.). | SÍ |
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 7 | Valor total de ventas netas | 16 | D | Valor total de ventas netas de los dispositivos en el mes y canal reportado. El campo permite hasta dos cifras decimales separados con separador decimal de punto (.). | SÍ |
| 8 | Total de unidades vendidas | 16 | N | Cantidad total de unidades de dispensación del dispositivo en el mes y canal reportado. Valor entero positivo sin separador de miles ni decimales. | SÍ |
| 9 | Número de factura del precio mínimo de venta del dispositivo | 30 | A | Número de la factura en la que se evidencia el precio mínimo de venta del medicamento reportado para el mes y canal reportado. El número de factura debe incluir el prefijo en los casos en que aplique | SÍ |
| 10 | Tipo de Identificación de la entidad compradora en la factura del precio mínimo de venta | 2 | A | Se debe especificar NI correspondiente al número de identificación tributaria NIT | SÍ |
| 11 | Número de identificación de la entidad compradora en la factura del precio mínimo de venta | 12 | N | Número de identificación de la entidad que compra el dispositivo, en la factura de menor valor, de acuerdo con el tipo de identificación del campo anterior. Número de NIT sin incluir el dígito de verificación para tipo de identificación NI. | SÍ |
| 12 | Total de unidades registradas del dispositivo en la factura del precio mínimo de venta | 10 | N | Cantidad de unidades de la presentación comercial del dispositivo en el mes y canal reportado. | SÍ |
| 13 | Número de factura del precio máximo de venta del dispositivo | 30 | A | Número de la factura en la que se evidencia el precio máximo de venta del medicamento reportado para el mes y canal reportado. El número de factura debe incluir el prefijo en los casos en que aplique | SÍ |
| 14 | Tipo de Identificación de la entidad compradora en la factura del precio máximo de venta | 2 | A | Se debe especificar NI correspondiente al número de identificación tributaria NIT | SÍ |
| 15 | Número de identificación de la entidad compradora en la factura del precio máximo de venta | 12 | N | Número de identificación de la entidad que compra el dispositivo, en la factura de menor valor, de acuerdo con el tipo de identificación del campo anterior. Número de NIT sin incluir el dígito de verificación para tipo de Identificación NI. | SÍ |
| 17 | Total de unidades registradas del dispositivo en la factura del precio máximo de venta | 10 | N | Cantidad de unidades de la presentación comercial del dispositivo en el mes y canal reportado. | 13 |
2. CARACTERÍSTICAS DE LOS ARCHIVOS PLANOS.
Los archivos deben ser tipo texto y cumplir con las siguientes especificaciones técnicas:
En el anexo técnico de los archivos, el tipo de dato, corresponde a los siguientes:
A- Alfanumérico N-Numérico D-decimal F-Fecha T-Texto con caracteres especiales
b) Todos los datos deben ser grabados como texto en archivos planos de formato ANSI, con extensión .txt
c) Los nombres de archivos y los datos de los mismos deben ser grabados en letras MAYÚSCULAS, sin caracteres especiales y sin tildes.
d) El separador de campos debe ser pipe (|) y debe ser usado exclusivamente para este fin. Los campos que corresponden a descripciones no deben incluir el mencionado carácter (|).
e) Cuando dentro de un archivo de datos se definan campos que no son obligatorios y que no sean reportados, este campo no llevará ningún valor, es decir debe ir vacío y reportarse en el archivo entre dos (|), por ejemplo si entre el dato1 y el dato3, el dato2 está vacío se reportará así: dato1||dato3.
f) Ningún dato en el campo debe venir encerrado entre comillas (“”) ni ningún otro carácter especial.
g) Los campos numéricos deben venir sin ningún formato de valor ni separación de miles. Para los campos que se permita valores decimales, se debe usar el punto como separador de decimales.
h) Los campos de tipo fecha deben venir en formato AAAA-MM-DD incluido el carácter guion, a excepción de las fechas que hacen parte del nombre de los archivos.
i) Las longitudes de campos definidas en los registros de control y detalle de este anexo técnico se deben entender como el tamaño máximo del campo, es decir que los datos pueden tener una longitud menor al tamaño máximo.
j) Los valores registrados en los archivos planos no deben tener ninguna justificación, por lo tanto no se les debe completar con ceros ni espacios.
k) Tener en cuenta que cuando los códigos traen CEROS, estos no pueden ser remplazados por la vocal 'O' la cual es un carácter diferente a cero.
l) Los archivos planos no deben traer ningún carácter especial de fin de archivo ni de final de registro. Se utiliza el ENTER como fin de registro.
m) Los archivos deben estar firmados digitalmente.
3. PLATAFORMA PARA EL ENVÍO DE ARCHIVOS.
El Ministerio de Salud y Protección Social dispondrá de la Plataforma de Intercambio de Información (PISIS) del Sistema Integral de Información de la Protección Social (SISPRO), para que las entidades reporten la información. Si el reportante aún no tiene usuario debe solicitarlo previo registro de su entidad en el Sitio Web del SISPRO.
Registrar entidad:
http://web.sispro.gov.co/WebPublico/Entidades/RegistrarEntidad.aspx
Registrar solicitud de usuario:
http://web.sispro.gov.co/Seguridad/Cliente/Web/RegistroSolicitudes.aspx
a) Control de calidad de los datos
La Plataforma PISIS recibe los archivos conformados según la estructura del presente anexo técnico y realiza el proceso de validación, así:
-- Primera validación: corresponde a la revisión de la estructura de los datos y se informa el estado de la recepción al reportante.
-- Segunda validación: Una vez realizada en forma exitosa la primera validación se realiza el control de calidad de contenido en el aplicativo misional y se informa al reportante el resultado.
Se entiende cumplida la obligación de este reporte una vez la segunda validación sea exitosa.
b) Mesa de ayuda
Con el propósito de brindar ayuda técnica para el reporte de los archivos, transporte de datos y demás temas relacionados, el Ministerio de Salud y Protección Social tiene dispuesta una mesa de ayuda. Los datos de contacto se encuentran en el siguiente enlace:
http://www.sispro.gov.co/recursosapp/Pages/Mesa_Ayudas.aspx
Adicionalmente, se dispone de documentación para el uso de la plataforma PISIS en el siguiente enlace:
http://web.sispro.gov.co/WebPublico/Soporte/FAQ/FAQ.aspx
c) Tratamiento de la información
Las entidades que participen en el flujo y consolidación de la información, serán responsables del cumplimiento del régimen de protección de datos y demás aspectos relacionados con el tratamiento de la información, que les sea aplicable en el marco de las Leyes Estatutarias 1581 de 2012, Ley 1712 de 2014, el Capítulo 25 del Título 2 del Libro 2 de la Parte 2 del Decreto 1074 de 2015, Único Reglamentario del Sector Comercio, Industria y Turismo y las normas que las modifiquen o sustituyan, en virtud de lo cual se hace responsable de la privacidad, seguridad, confidencialidad y veracidad de la información suministrada y sobre los datos de los cuales se tiene acceso.
d) Seguridad de la información
Para garantizar la seguridad y veracidad de la información reportada, las entidades deben enviar los archivos firmados digitalmente, lo cual protege los archivos garantizando su confidencialidad, integridad y no repudio. Para firmar digitalmente los archivos, se debe usar un certificado digital emitido por una entidad certificadora abierta aprobada por la entidad competente.
4. PERIODO DE REPORTES Y PLAZOS.
La periodicidad del envío de esta información es trimestral en los plazos establecidos a continuación:
| Fecha de corte de la información a reportar | Plazo para enviar el archivo plano | |
| Desde | Hasta | |
| 2017-09-30 | 2017-10-01 | 2017-10-31 |
| 2017-12-31 | 2018-02-01 | 2018-02-15 |
| 2018-03-31 | 2018-04-01 | 2018-04-30 |
| Y así sucesivamente | ||
| Último día calendario del mes a reportar | Primer día calendario del mes siguiente | Último día calendario del mes siguiente * Excepto para febrero. En caso que el día 15 corresponda a un día no hábil, el plazo se vencerá al día hábil siguiente |






