 DATOS
DATOS
 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
 DESCARGAS
DESCARGAS
 DESARROLLOS
DESARROLLOS
 MODIFICACIONES
MODIFICACIONES
 CONCORDANCIAS
CONCORDANCIAS
 NOTIFICACIONES
NOTIFICACIONES
 ACTOS DE TRÁMITE
ACTOS DE TRÁMITE
 ABOGACÍA
ABOGACÍA
 VIDEOS
VIDEOS
CIRCULAR 10 DE 2020
(enero 27)
Diario Oficial No. 51.209 de 27 de enero 2020
COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
<NOTA DE VIGENCIA: Circular derogada por el artículo 12 de la Circular 12 de 2021>
Por la cual se unifica y se adiciona el listado de los medicamentos sujetos al régimen de control directo de precios, se fija su Precio Máximo de Venta, se actualiza el precio de algunos medicamentos conforme al Índice de Precios al Consumidor (IPC) y se dictan otras disposiciones.
LA COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS,
en uso de sus facultades legales, en especial las conferidas por los artículos 245 de la Ley 100 de 1993, modificado por el artículo 87 de la Ley 1438 de 2011, 72 de la Ley 1753 de 2015 y por el Decreto 705 de 2016 y,
CONSIDERANDO:
Que el artículo 245 de la Ley 100 de 1993, modificado por el artículo 87 de la Ley 1438 de 2011 y el artículo 1o Decreto 705 de 2016, determinó que la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos (CNPMDM) (en adelante la Comisión), tendrá la potestad de definir la formulación y mecanismos para la regulación de la política de precios de medicamentos y dispositivos médicos, así como la regulación de los márgenes de distribución y comercialización de estos;
Que la Comisión tiene la facultad de incluir cualquier medicamento al régimen de control directo de precios, en el marco normativo y bajo los postulados constitucionales, legales y reglamentarios previstos para el efecto;
Que la Política Farmacéutica Nacional expedida mediante el Documento Conpes Social 155 de 2012, orientó a la Comisión para desarrollar una política de precios de medicamentos que contribuya a detectar y resolver las distorsiones del mercado;
Que la política de precios de medicamentos enmarcada en la Estrategia 4 del citado Conpes, tiene por objeto hacer compatibles las necesidades de salud pública con los principios de competencia, comercio y viabilidad de la inversión, así como producir beneficios en salud que justifiquen sus costos;
Que la Comisión expidió la Circular 03 de 2013, mediante la cual se estableció la metodología para la aplicación del régimen de control directo de precios para los medicamentos que se comercialicen en el territorio nacional;
Que la Circular 04 de 2013, modificada por la Circular 05 de 2013; la Circular 01 de 2014; la Circular 03 de 2017, modificada por la 04 de 2018 y la Circular 07 de 2018, modificada por las Circulares 08 de 2018 y 09 de 2019, incorporaron unos medicamentos al régimen de control directo de precios y fijaron unos Precios Máximos de Venta;
Que la Circular 07 de 2013, incorporó unos medicamentos al régimen de control directo de precios, fijó unos Precios Máximos de Venta, y al tenor de su artículo 1o determinó el criterio para la conformación de los subconjuntos de medicamentos de mayor participación;
Que los medicamentos sometidos al proceso de referenciación internacional en el segundo semestre de 2019 se encuentran divididos en tres categorías, a saber: i) medicamentos nuevos que se incluyen por primera vez al régimen de control directo; ii) medicamentos que se encuentran regulados por metodologías anteriores a la establecida en la Circular 03 de 2013, y iii) Medicamentos Vitales No Disponibles (MVND);
Que, si bien algunos medicamentos de los Mercados Relevantes se transan en el canal comercial, todos los Mercados Relevantes priorizados para el proceso de referenciación internacional de precios de medicamentos fueron seleccionados indistintamente del canal de comercialización y, así mismo, todos estos cumplen con los criterios de concentración de mercado o menos de tres oferentes establecidos en la metodología de regulación de precios de medicamentos contenida en la Circular 03 de 2013;
Que los registros sanitarios de los medicamentos asociados a los siguientes Mercados Relevantes: 545/573 Interferón Alfa–2B Pegilado Líquido/Sólido – Inyectable; 406/407 Interferón Alfa–2A Pegilado Líquido/Sólido – Inyectable; 554 Itraconazol Líquido/ Sólido – Inyectable; 466 Galantamina Sólido – Oral, y 422 Aliskireno Sólido – Oral, fueron regulados por metodologías anteriores a la Circular 03 de 2013, y no se encuentran vigentes, en consecuencia estos Mercados Relevantes no serán unificados en la presente Circular;
Que en aplicación a la metodología de la Circular 03 de 2013, fueron publicados en la página web del Ministerio de Salud y Protección Social, desde el 21 de agosto de 2019 hasta el 16 de septiembre de 2019, los anexos que contienen todos los insumos e información para la conformación de los Mercados Relevantes a regular así: i) Estandarización de la base de datos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima); ii) Cálculo del índice Herfindahl Hirschman (IHH); iii) Medicamentos Vitales No Disponibles (MVND); y iv) Formas farmacéuticas de los medicamentos sometidos al proceso de referenciación internacional en el segundo semestre de 2019;
Que la Comisión con base en los países de referencia, determinó que para los medicamentos que serán sometidos a régimen de control directo de precios a través de la presente Circular, el factor de ajuste promedio entre el punto ex fábrica y el punto mayorista, será el 7,05%;
Que para las presentaciones comerciales de medicamentos que no registraron reportes a nivel de ventas del productor o importador en el Sismed durante el período de referencia del 1 de julio de 2018 al 30 de junio de 2019, se realizó una reconstrucción lineal del precio de la presentación comercial a partir del precio de los otros consecutivos del mismo expediente de registro sanitario que sí reportaron ventas en dichos niveles;
Que respecto de los medicamentos que ya se encuentran en régimen de control directo de precios en anteriores circulares emanadas de esta CNPMDM, se actualizarán conforme a la variación del Índice de Precios al Consumidor (IPC), resultante de la sumatoria del IPC mensual publicado por el DANE, contado a partir del mes de entrada en vigor de cada una de las siguientes Circulares, acumulados a diciembre de 2019, así: Circular 04 de 2018: para los mercados relevantes que entraron en vigencia el 1 de marzo de 2018 con un 5,53%, para los mercados relevantes que entraron en vigencia el 2 de abril de 2018 con un 5,29%; Circular 07 de 2018 (entró en vigencia en el 1 de enero de 2019) con un 3,74% y los de la Circular 09 de 2019 (entró en vigencia el 8 julio de 2019) con un 1,06%;
Que en aplicación del literal a) del artículo 21 de la Circular 03 de 2013, los Medicamentos Vitales No Disponibles (MVND) se seleccionaron con base en la información suministrada por la Administradora de los Recursos del Sistema General de Seguridad Social en Salud (ADRES);
Que la CNPMDM efectuó la revisión del listado de medicamentos regulados por el régimen de control directo de precios, contenidos en la Circular 04 de 2013, modificada por la Circular 05 del mismo año; la Circular 07 de 2013, la Circular 01 de 2014; la Circular 04 de 2018, la Circular 07 de 2018, modificada por las Circulares 08 de 2018 y 09 de 2019, concluyendo que existen diferencias en la información consignada en los registros sanitarios y que algunos medicamentos no cumplen con los criterios previstos en la metodología de la Circular 03 de 2013, por lo que no serán tenidos en cuenta en la unificación del listado de medicamentos a incorporar en la presente Circular;
Que la Secretaría Técnica de la Comisión envió en el año 2013 a la Superintendencia de Industria y Comercio, en adelante SIC, la Circular 03 de 2013 que adopta la metodología general de referenciación internacional de precios para que se emitiera concepto de abogacía de la competencia, en el marco de lo dispuesto en artículo 7o de la Ley 1340 de 2009 y el Decreto 1074 de 2015, para lo cual esa Superintendencia con radicado SIC e13-117101-3-0 del 17 de mayo de 2013, conceptuó que “(…) las medidas contenidas en el proyecto de Circular no tienden a generar un efecto anticompetitivo respecto de los precios máximos para la comercialización de medicamentos en el país (…)”. En el marco de la expedición de la Circular 07 de 2018, se consultó a la SIC sobre la necesidad de que dicha Circular hubiera surtido el procedimiento de abogacía de la competencia, y en respuesta a esta consulta, la SIC, con Radicado 18-281397-1-0 del 8 de noviembre de 2018, conceptuó que “(…) la Superintendencia de Industria y Comercio considera, frente a la solicitud concreta, que la Circular 07 de 2018 no tenía necesidad de surtir el trámite de abogacía de la competencia. Esta conclusión se desprende del hecho de que la Circular 07 de 2018 corresponde a una aplicación de la metodología establecida en la Circular 03 de 2013 (…)”;
Que, considerando que lo dispuesto en la presente circular atiende la aplicación de la metodología establecida en la Circular 03 de 2013, sometida al trámite de abogacía de la competencia se hace extensivo el concepto dado por la SIC en su momento, respecto de la Circular 07 de 2018;
Que la CNPMDM en sesión del 16 de diciembre de 2019, determinó la necesidad de unificar, adicionar y actualizar el listado de los medicamentos sujetos al régimen de control directo de precios en el país;
Que lo dispuesto en la presente Circular fue sometido a consulta pública entre el 21 de noviembre al 9 de diciembre de 2019, recibiendo comentarios de la ciudadanía que se analizaron y constituyen el fundamento de algunas decisiones adoptadas.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. <Circular derogada por el artículo 12 de la Circular 12 de 2021> Incorporación de medicamentos a control directo. Incorpórense al régimen de control directo de precios en el nivel mayorista, los medicamentos que se relacionan a continuación:
<Consultar directamente modificaciones a este artículo, en el artículo 1 Circular 11 de 2020>
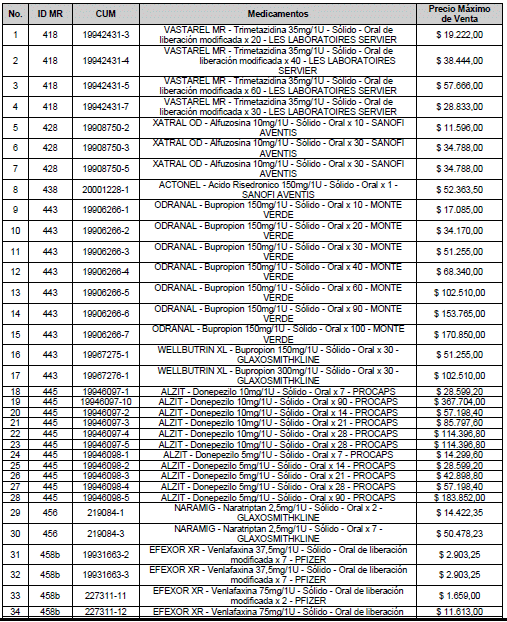
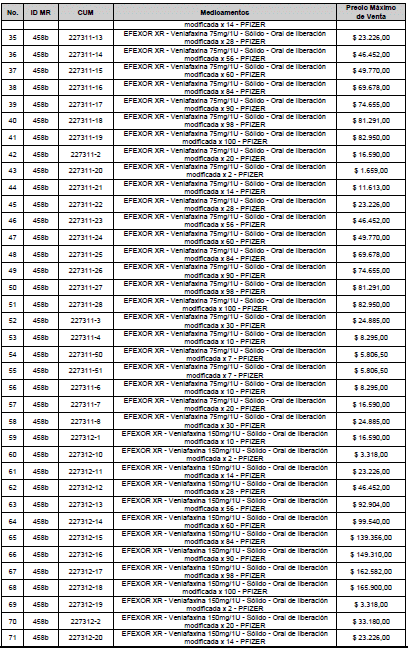
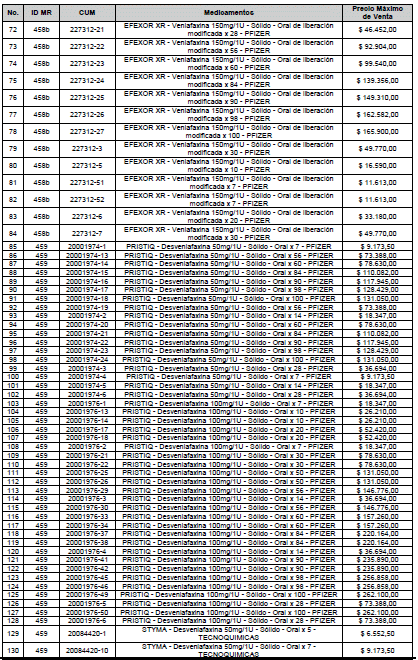
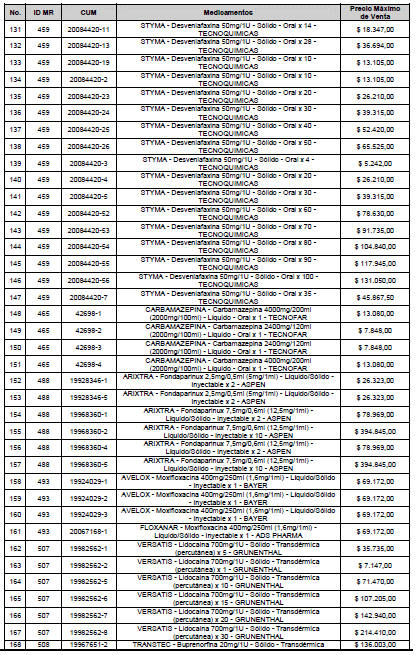
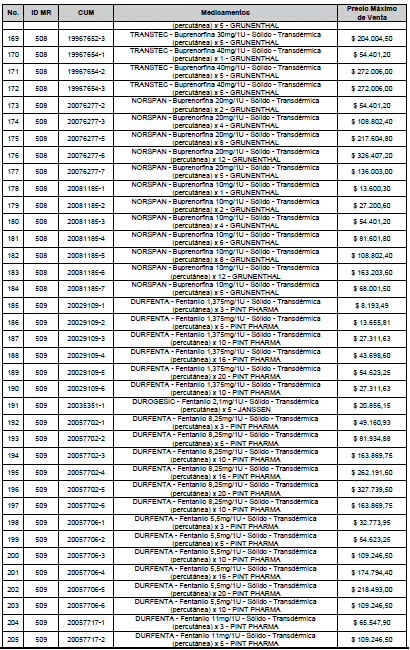
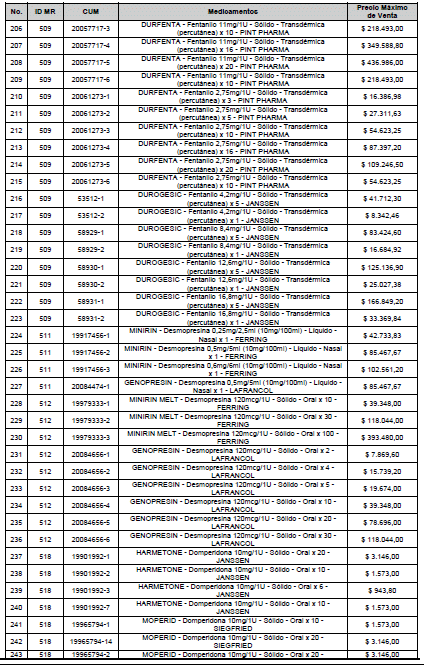
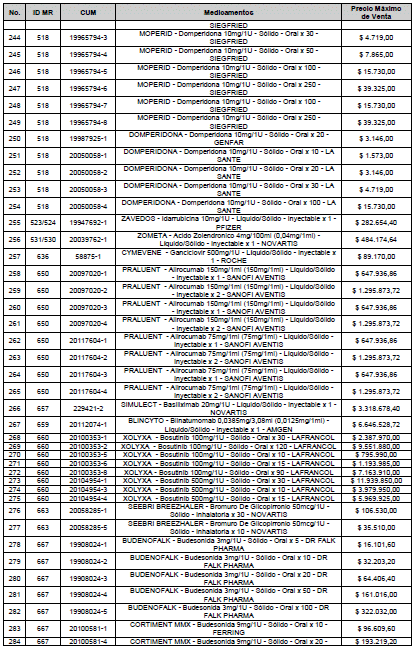
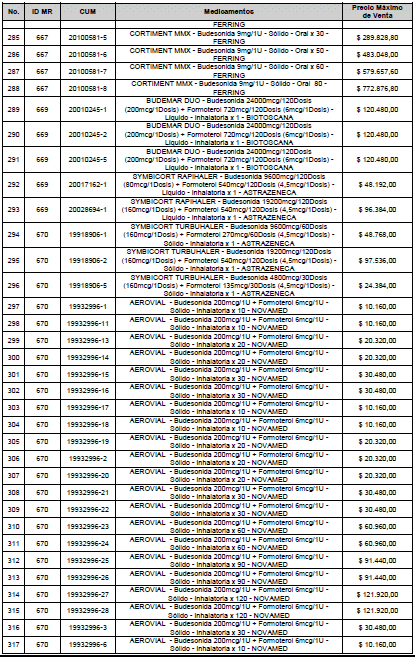
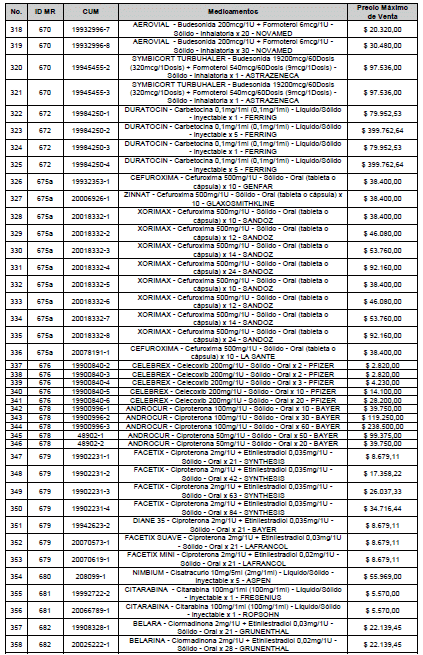
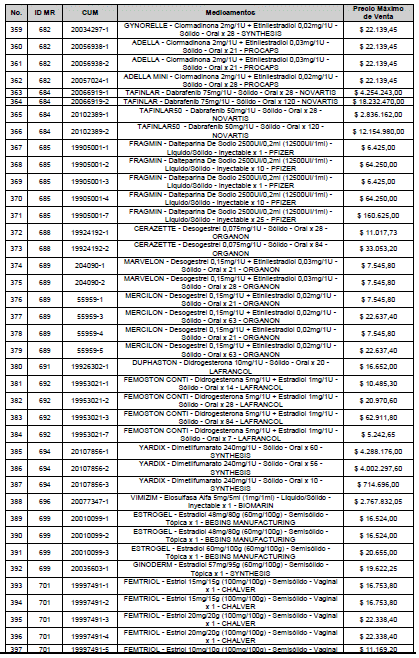
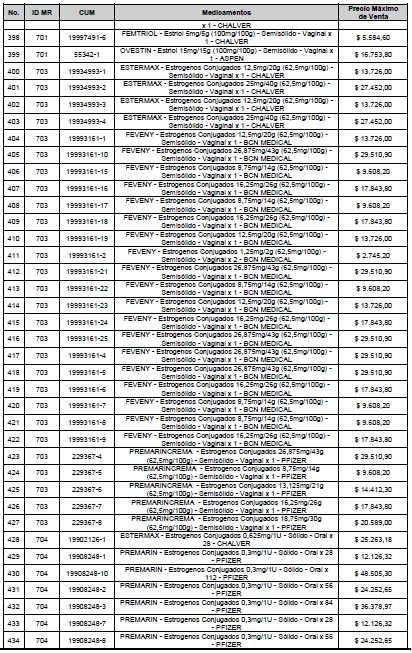
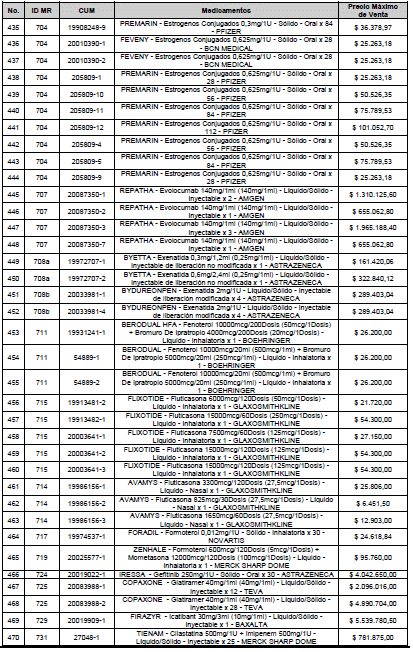
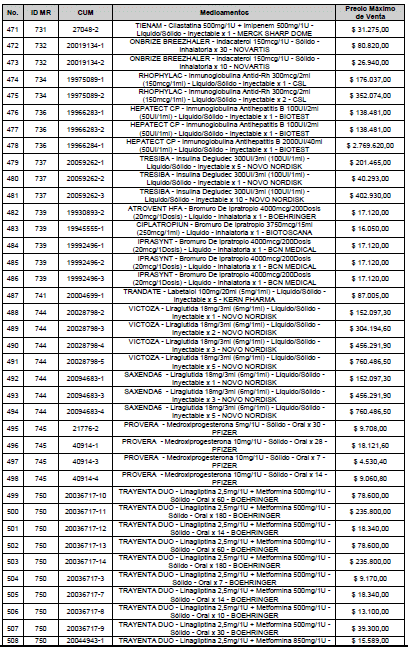
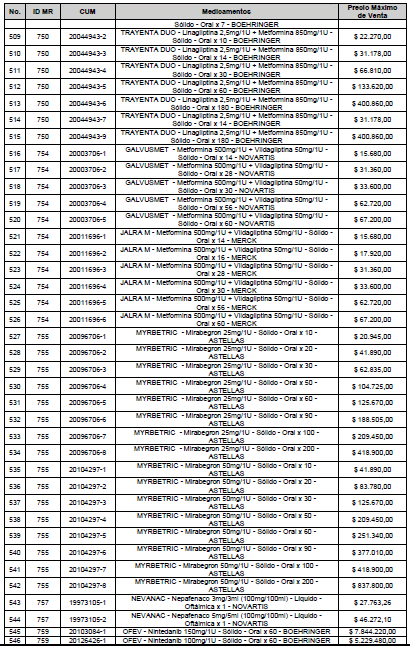
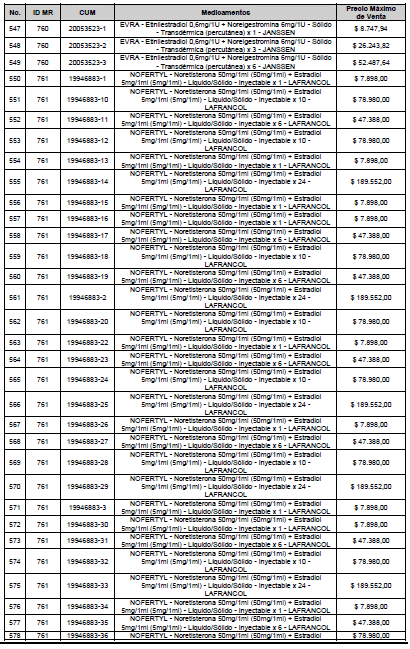
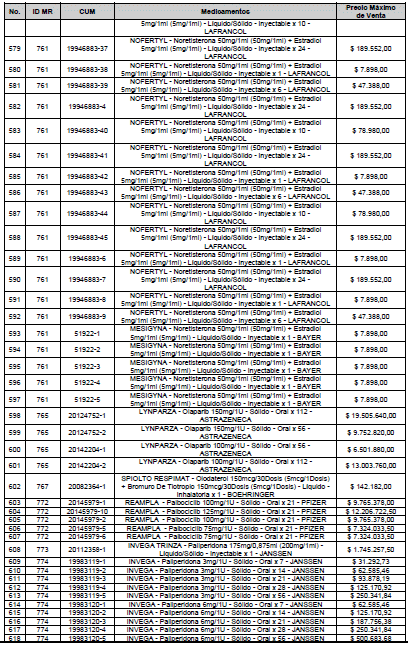
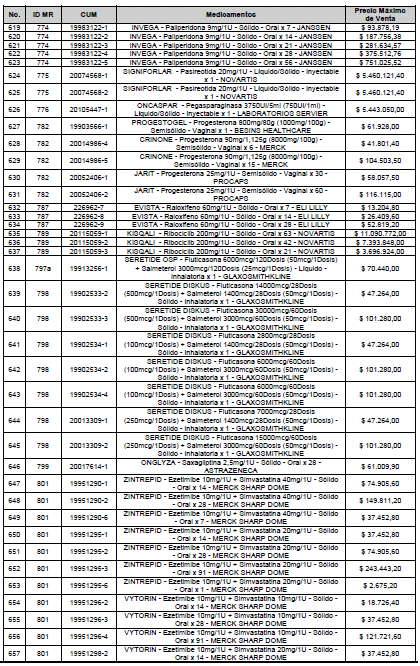
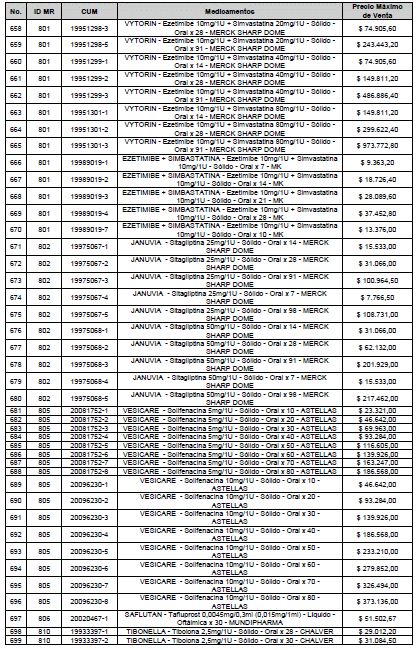
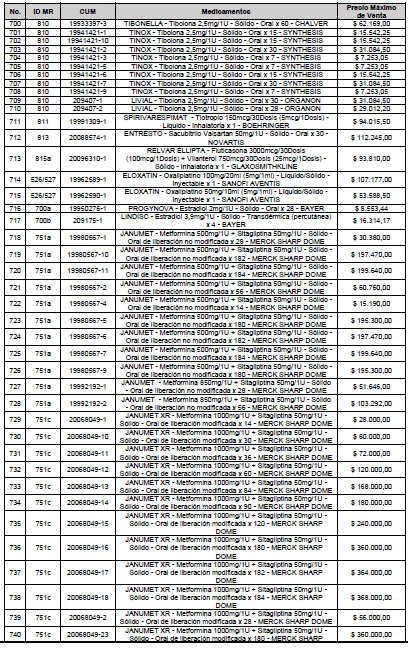
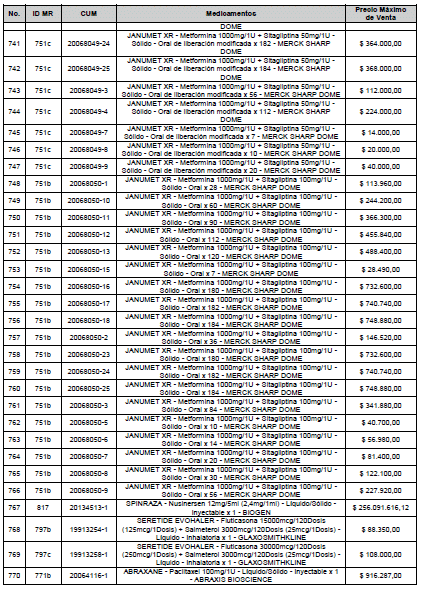
ARTÍCULO 2o. FACTOR DE AJUSTE PROMEDIO. <Circular derogada por el artículo 12 de la Circular 12 de 2021> El Precio Máximo de Venta establecido en el artículo anterior contempla los factores de ajuste que corresponde al promedio observado en los países de referencia entre el punto ex fábrica y el punto mayorista, y es del 7,05%.
ARTÍCULO 3o. ACTUALIZACIÓN DEL PRECIO MÁXIMO DE VENTA DE LOS MEDICAMENTOS REGULADOS POR LA COMISIÓN. <Circular derogada por el artículo 12 de la Circular 12 de 2021> Actualícese el Precio Máximo de Venta de los medicamentos regulados por la Comisión en anteriores actos administrativos, en aplicación de la variación del IPC, conforme con lo expuesto en la parte considerativa de la presente Circular, así:
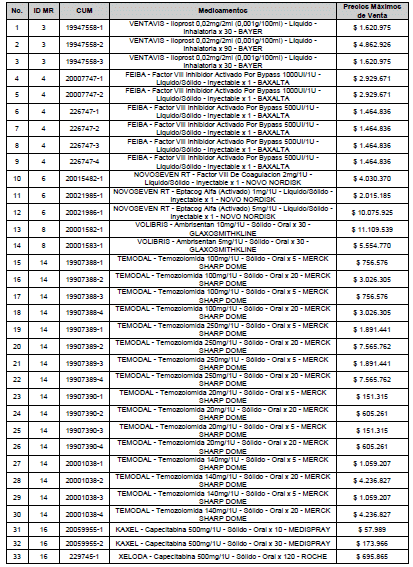
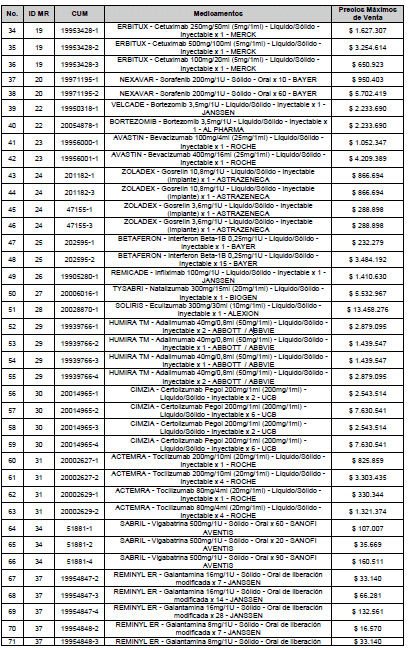
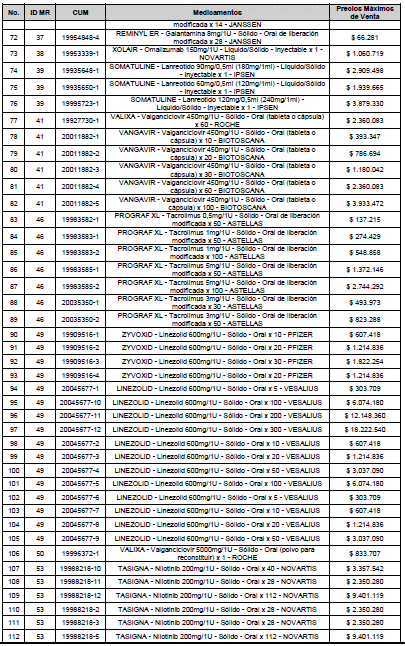
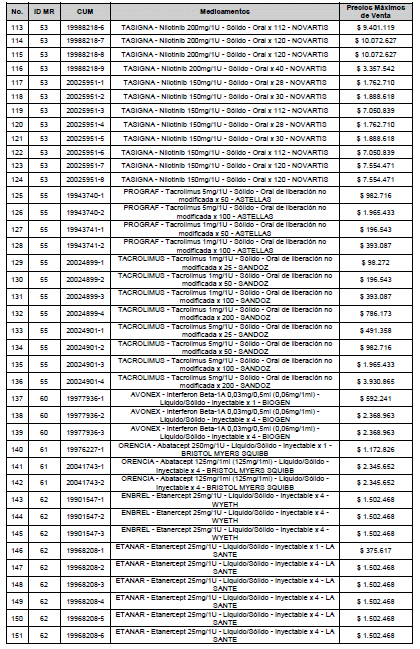
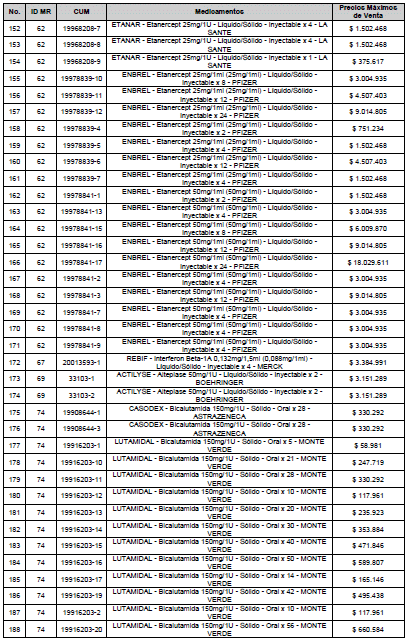
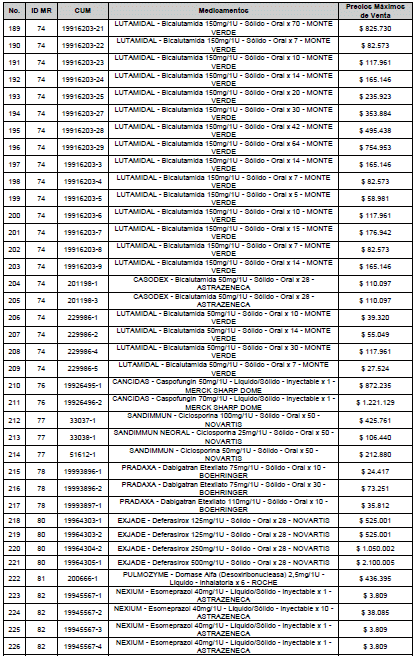
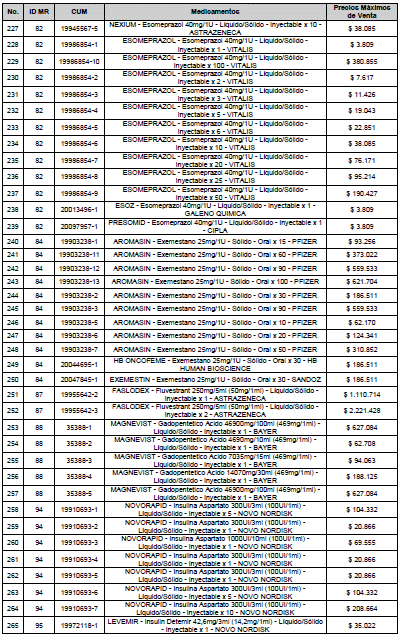
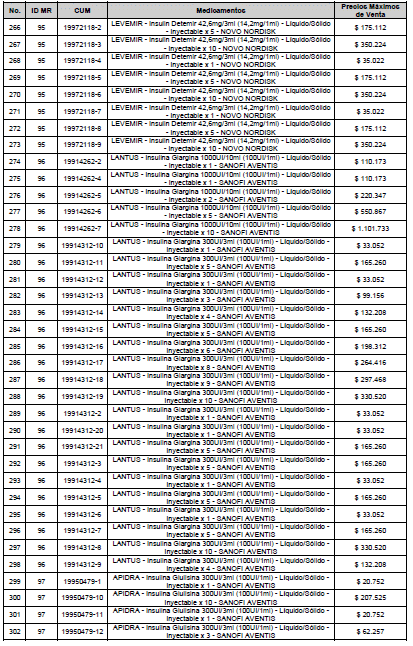
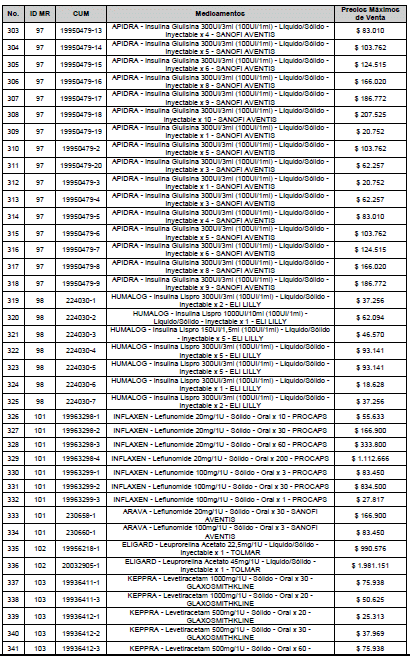
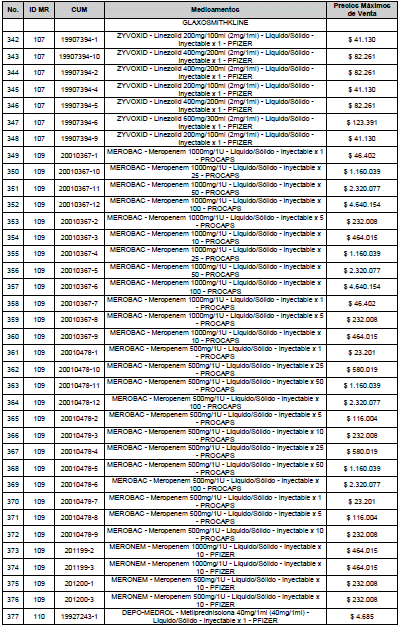
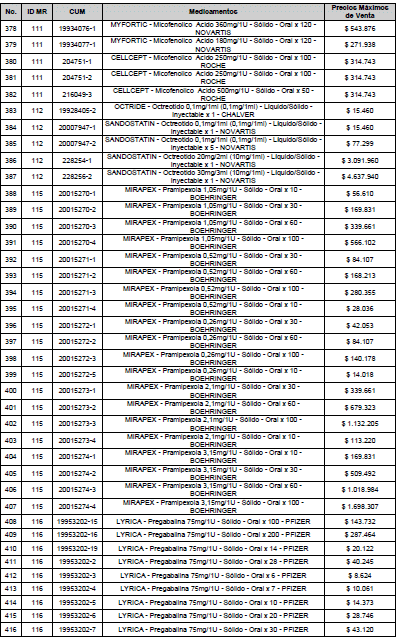
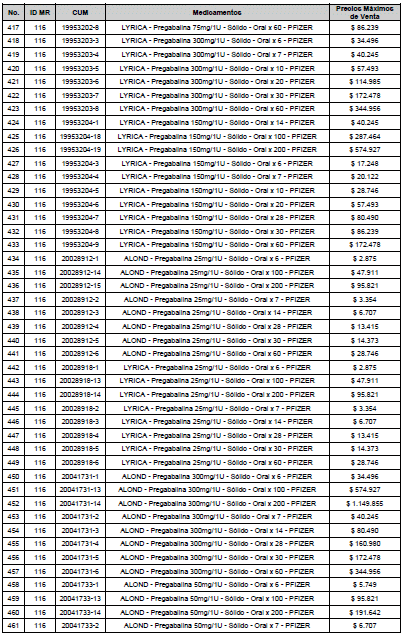
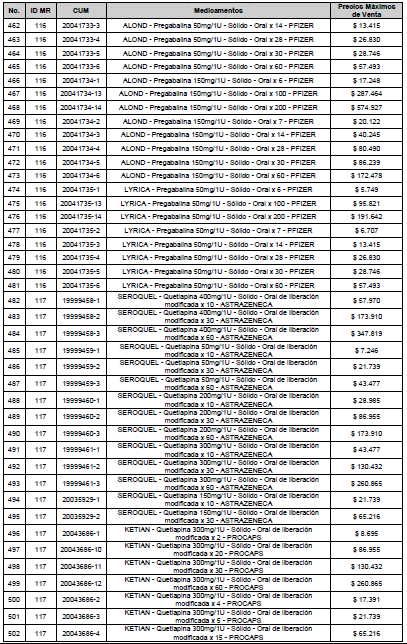
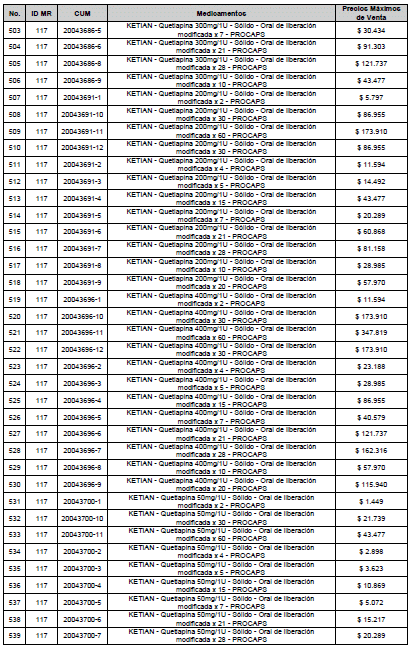
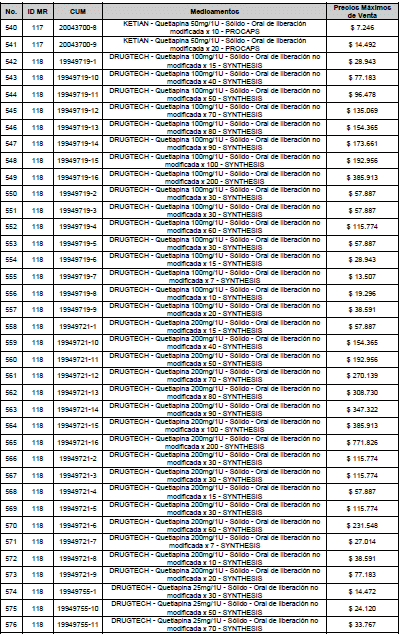
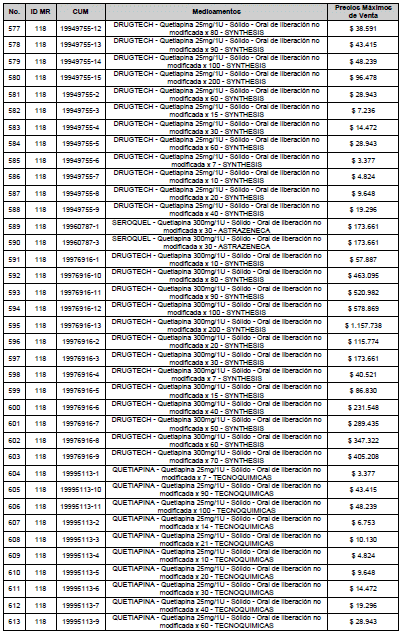
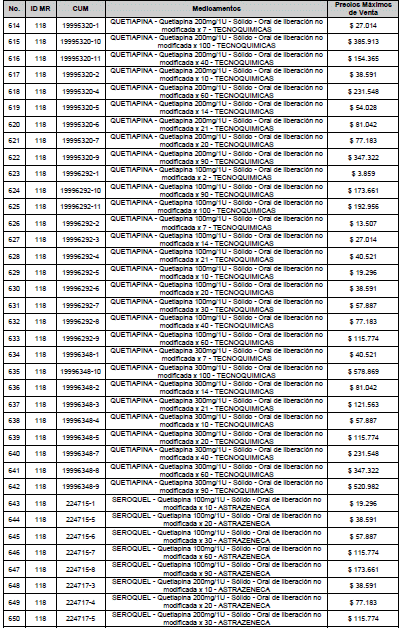
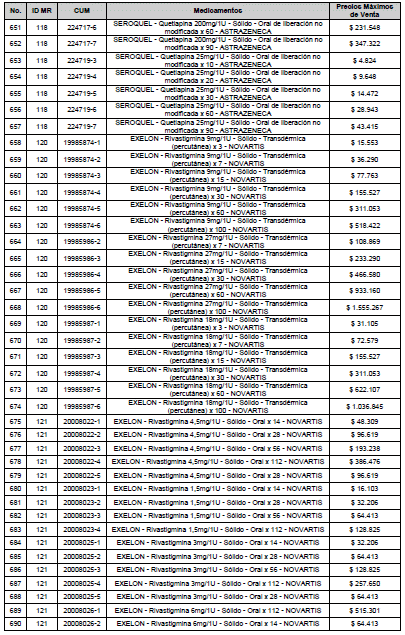
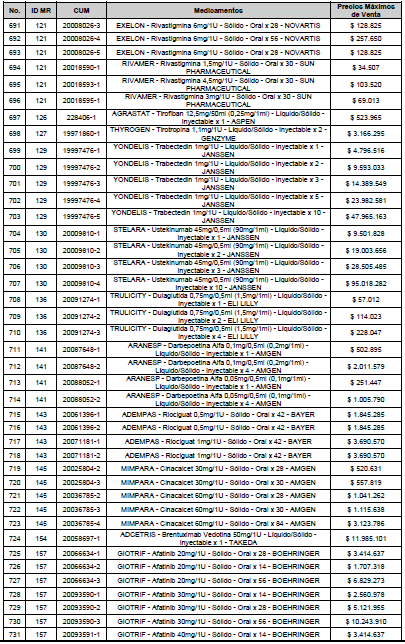
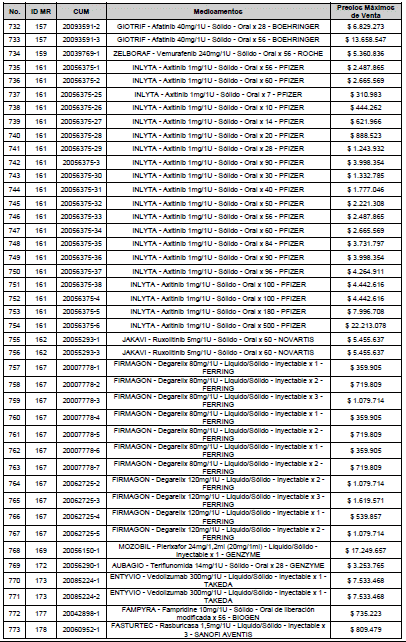
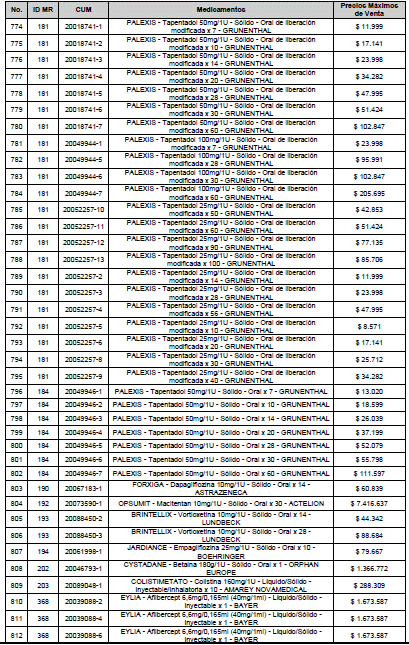
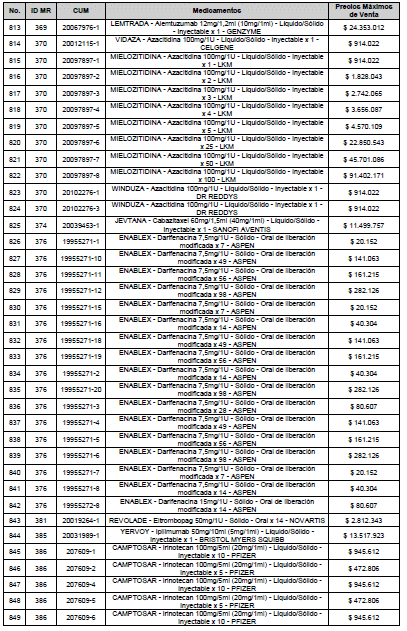
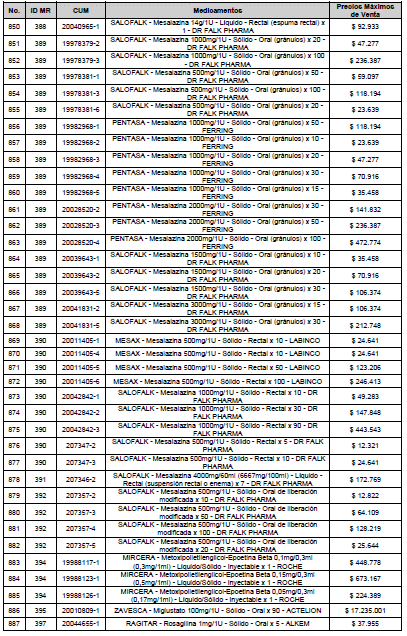
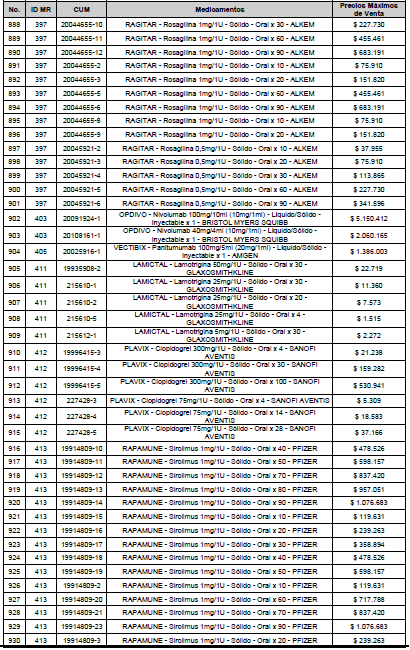
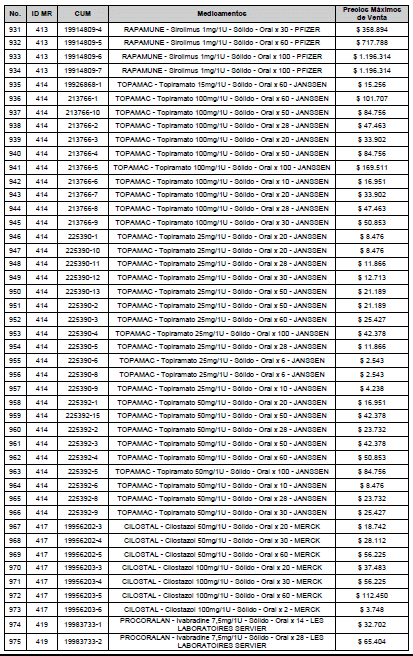
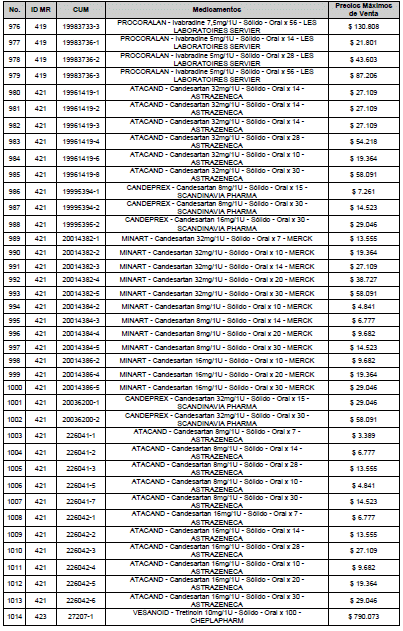
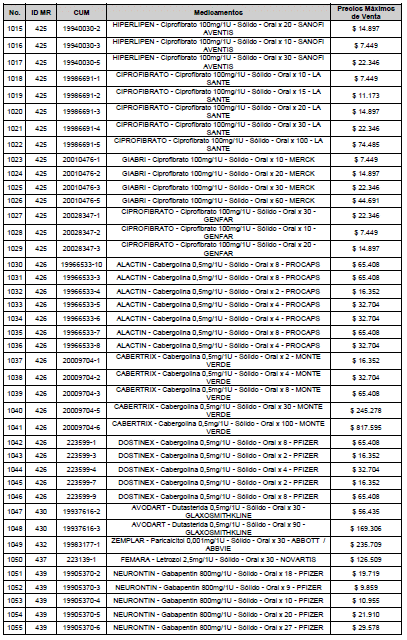
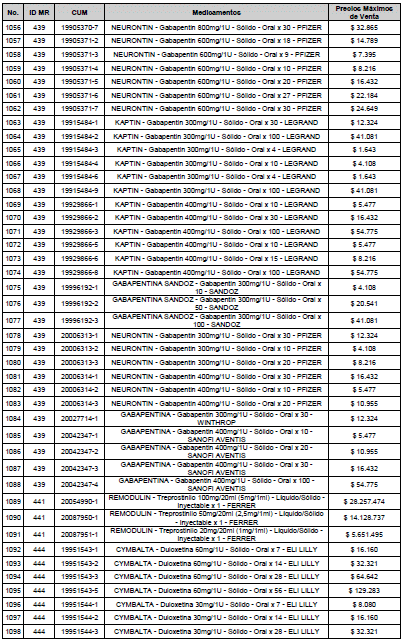
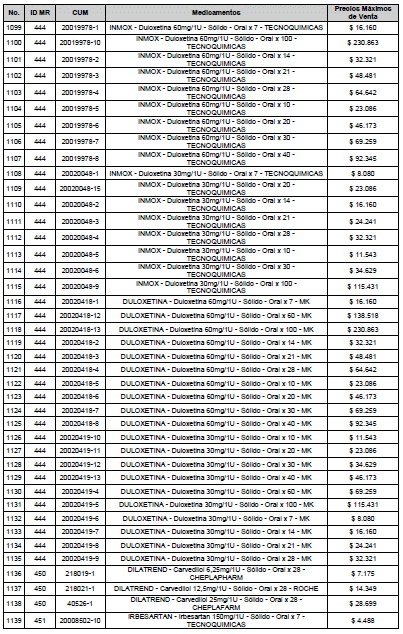
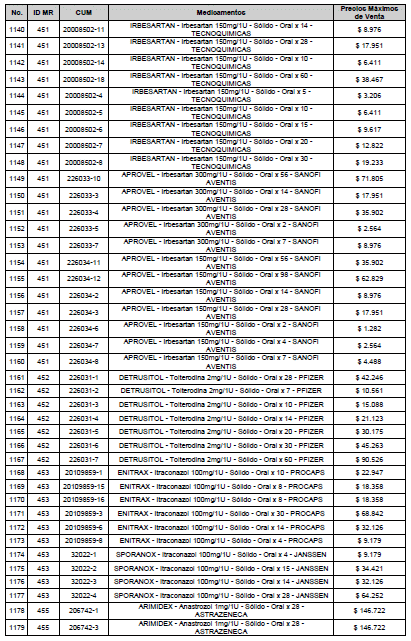
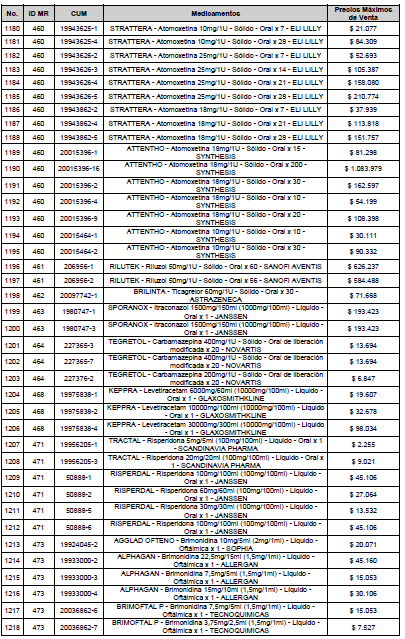
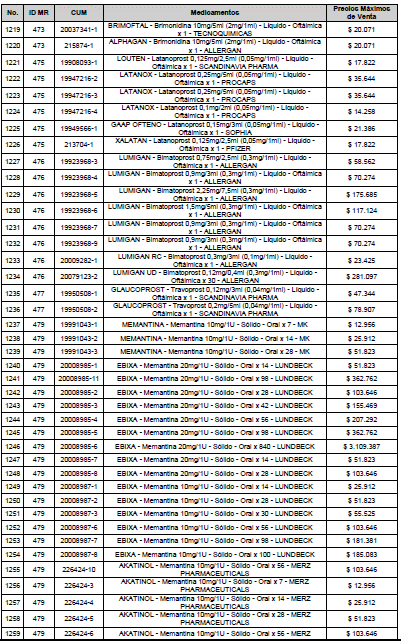
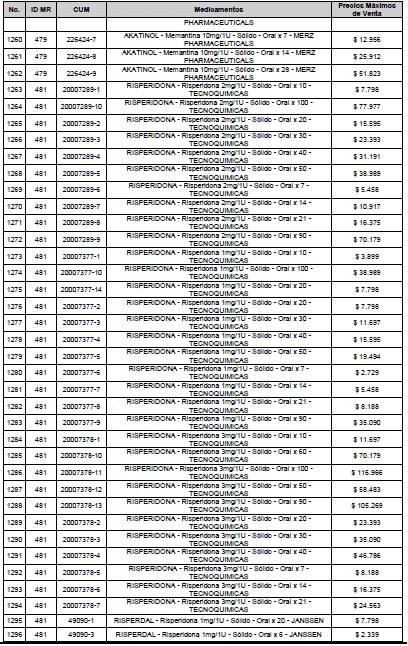
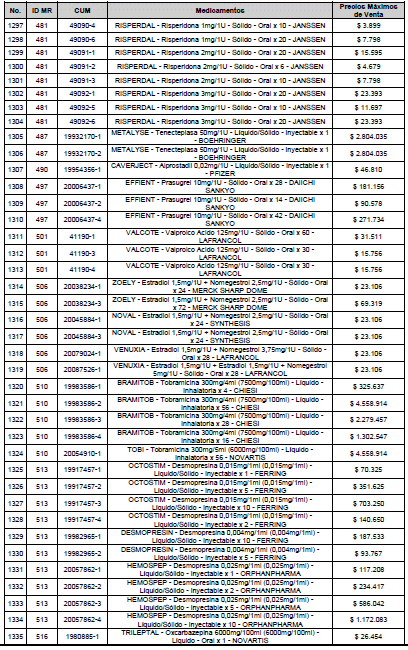
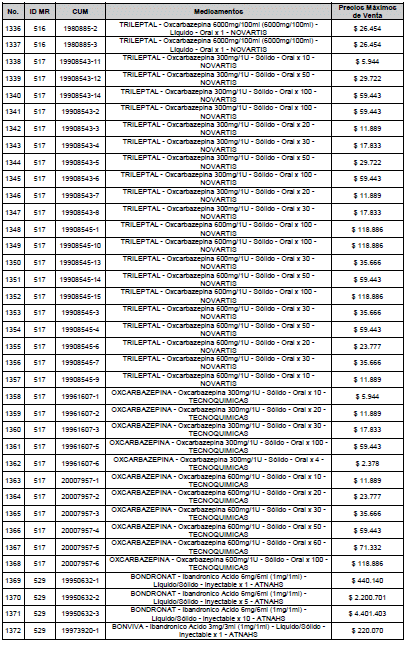
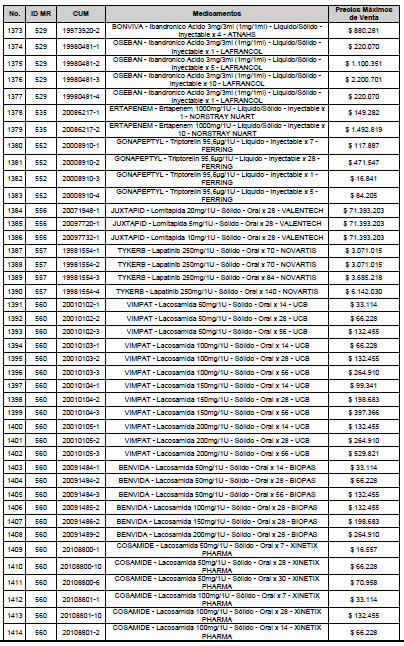
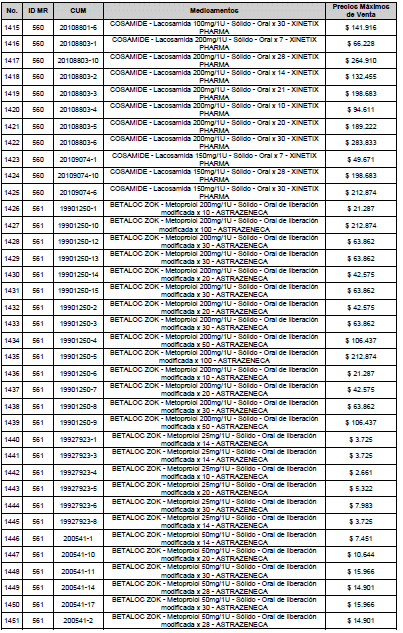
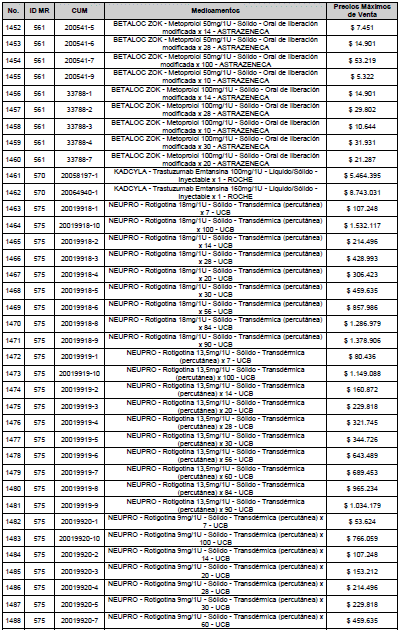
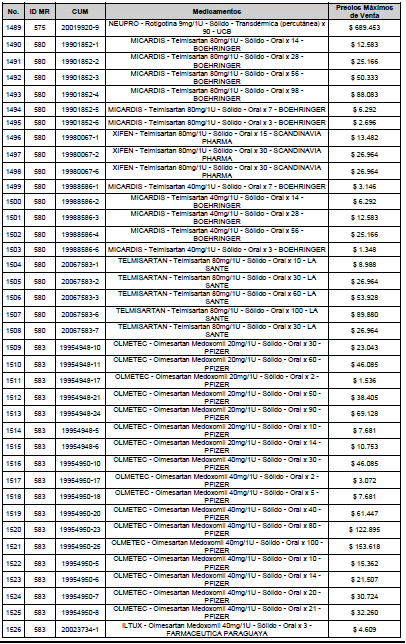
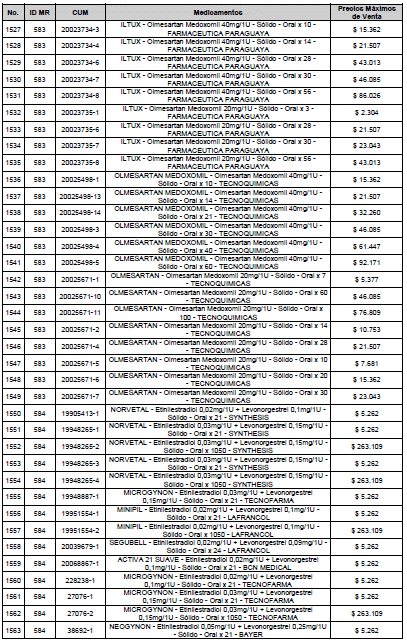
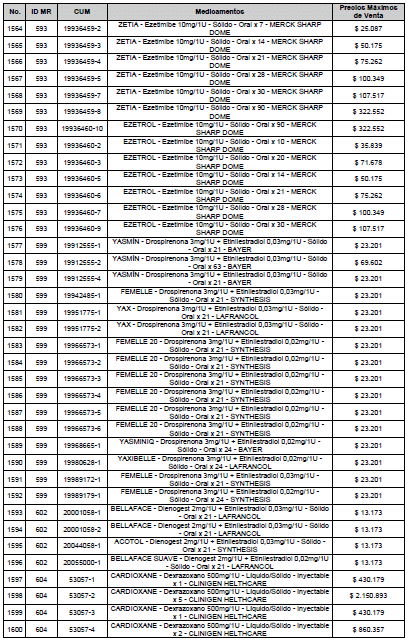
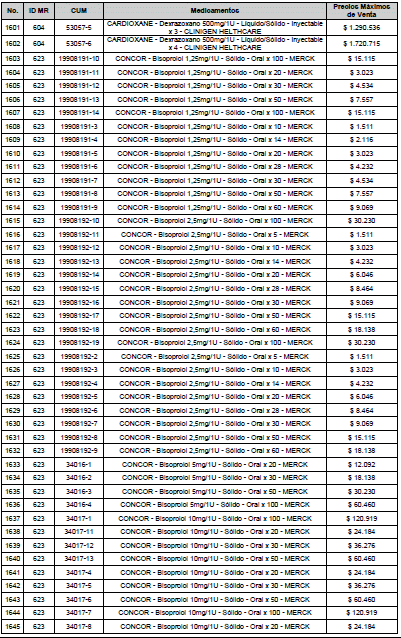
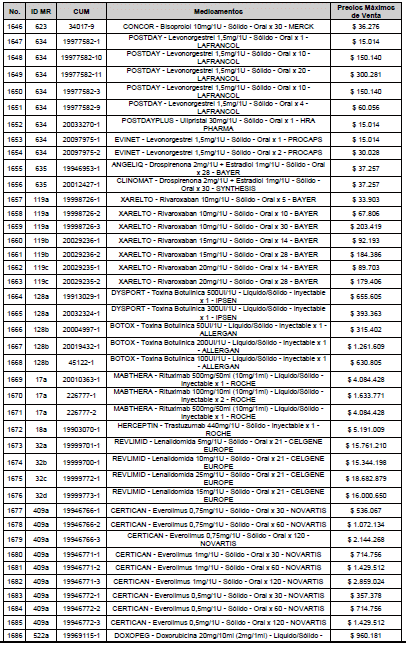
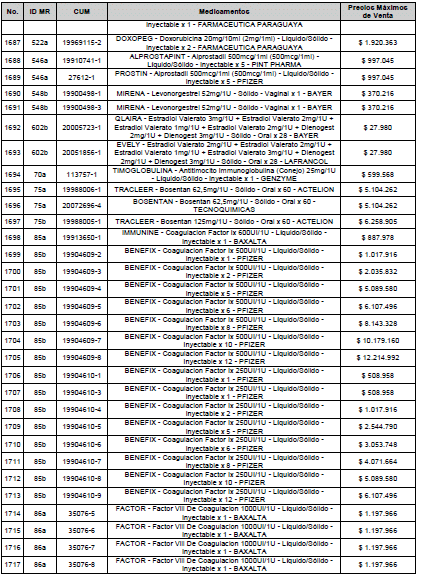
PARÁGRAFO. El Precio Máximo de Venta del Mercado Relevante Toxina Botulínica solo aplicará para su uso terapéutico. Cualquier uso de estos medicamentos en el canal institucional se entenderá como terapéutico y no podrá exceder el precio regulado. En las transacciones comerciales, el precio regulado aplicará solo para el uso terapéutico
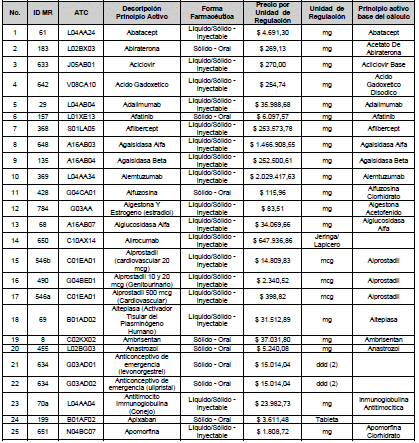
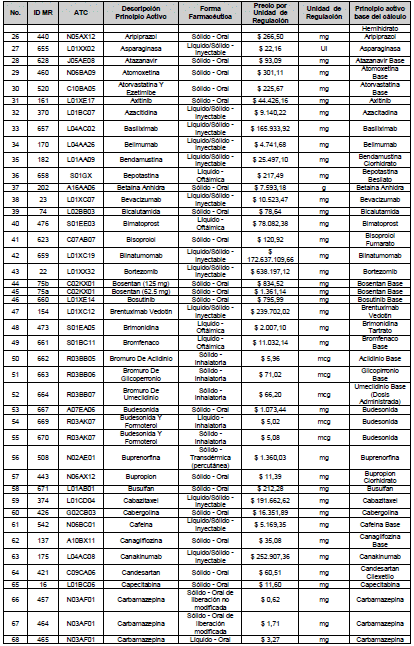
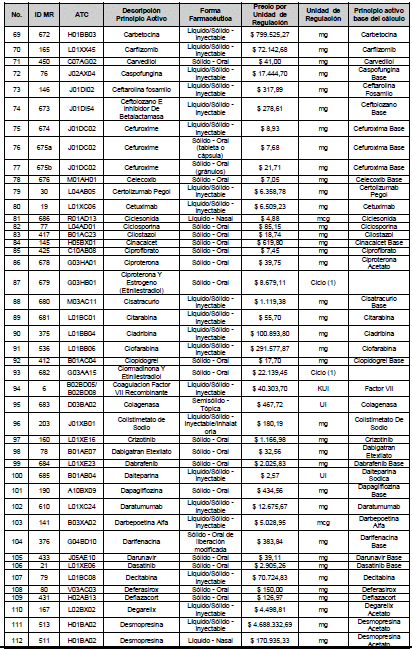
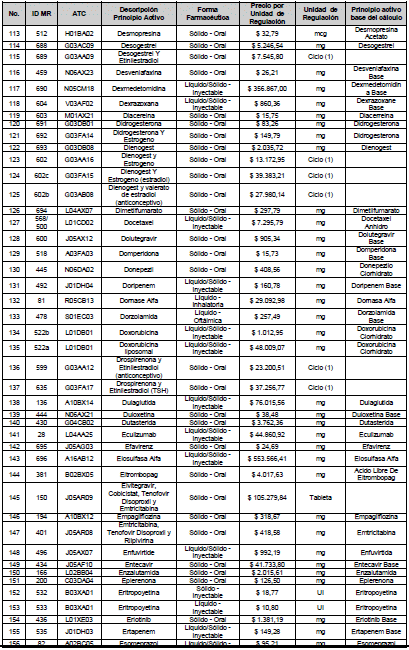
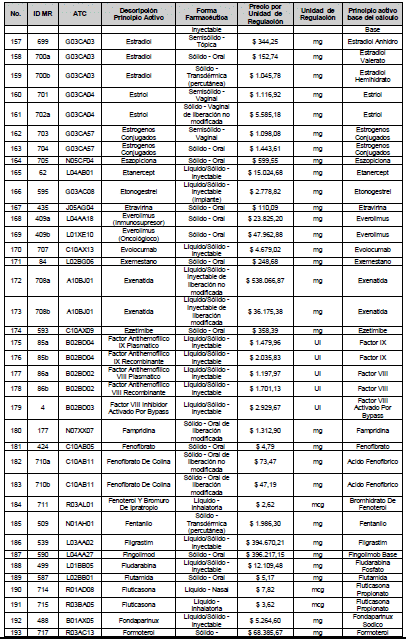
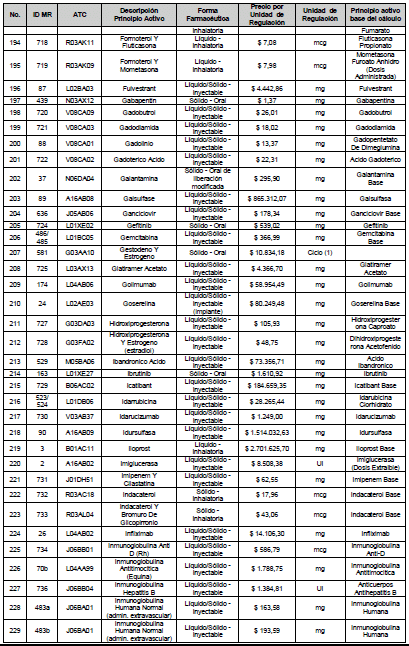
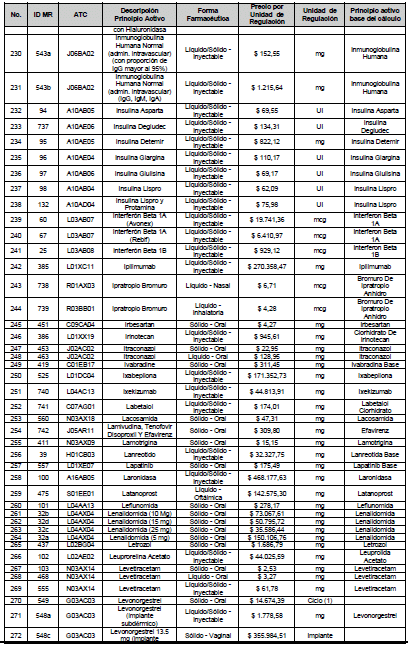
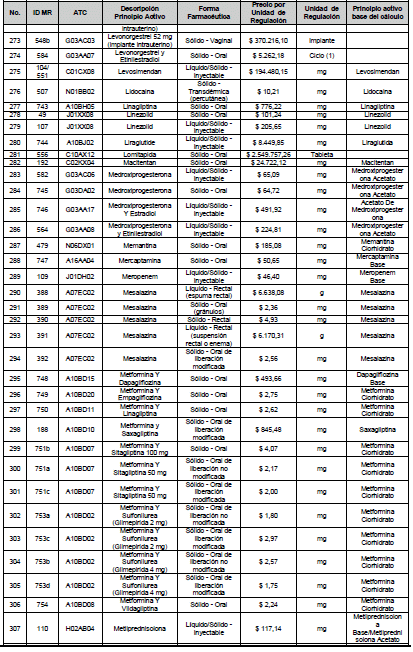
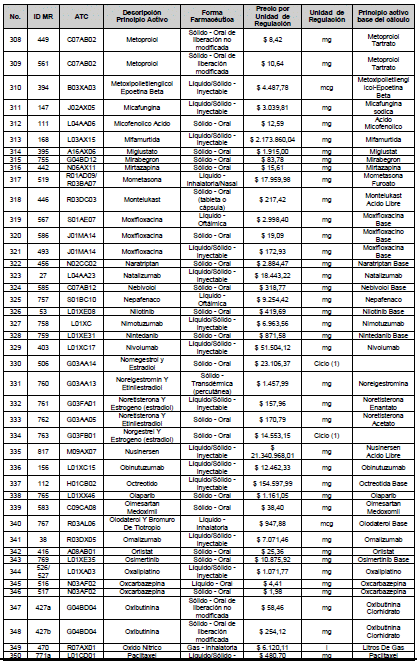
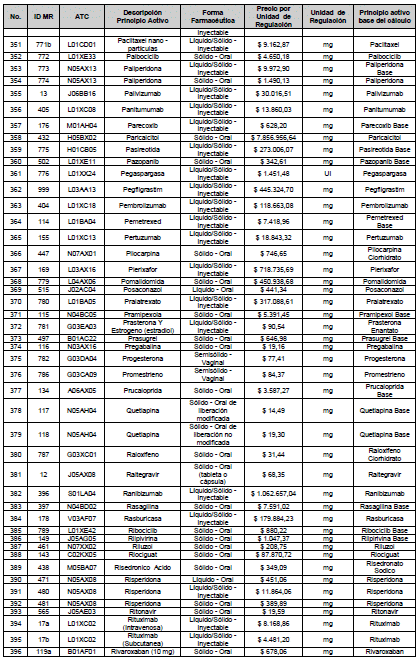
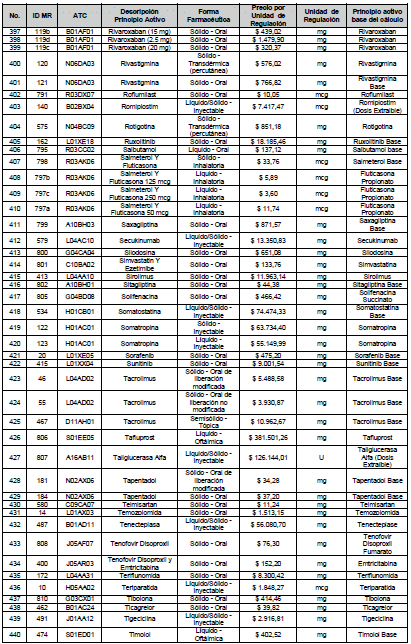
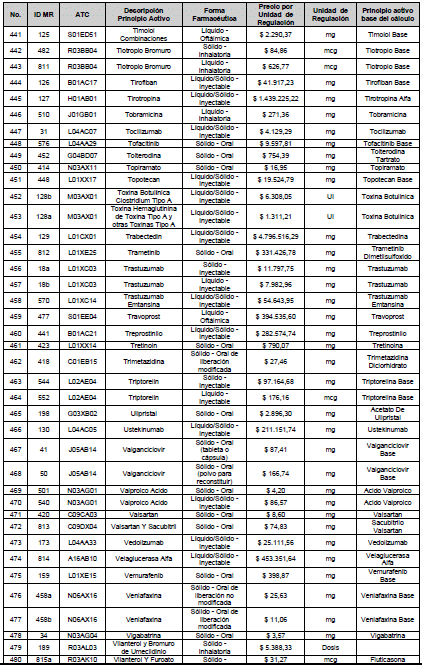
ARTÍCULO 4o. PRECIO POR UNIDAD DE REGULACIÓN DE MERCADOS RELEVANTES SOMETIDOS A LA METODOLOGÍA DE LA CIRCULAR 03 DE 2013. <Circular derogada por el artículo 12 de la Circular 12 de 2021> El Precio por unidad de regulación para todos los Mercados Relevantes o subconjuntos de estos, que a la fecha han sido sometidos a la metodología de la Circular 03 de 2013, se establecen en la tabla del presente artículo. Estos constituyen un Precio Máximo de Venta para las operaciones realizadas en las transacciones institucionales.
PARÁGRAFO 1o. Para aquellos medicamentos que se encuentran financiados con recursos de la Unidad de Pago por Capitación –UPC sin indicaciones condicionadas, los precios establecidos sólo corresponden a un precio de referencia para el mercado.
PARÁGRAFO 2o. Los precios de presentaciones comerciales no mencionadas en los anteriores artículos, al igual que las nuevas presentaciones comerciales de medicamentos que conforman Mercados Relevantes regulados en la presente Circular, deben acogerse a lo previsto en este artículo.
<Consultar directamente modificaciones a este artículo, en el artículo 2 Circular 11 de 2020>
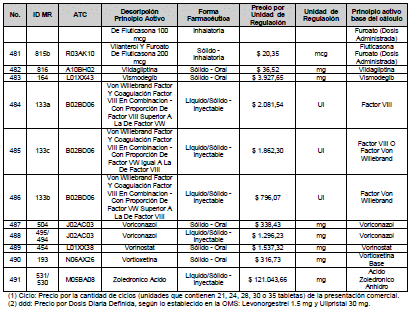
ARTÍCULO 5o. PRECIO POR UNIDAD DE REGULACIÓN DE MEDICAMENTOS VITALES NO DISPONIBLES. <Circular derogada por el artículo 12 de la Circular 12 de 2021> El Precio Máximo de Venta por unidad de regulación de los siguientes Medicamentos Vitales No Disponibles para las operaciones realizadas con recursos asignados a la salud, es el siguiente:

ARTÍCULO 6o. MONITOREO DEL COMPORTAMIENTO DE LOS PRECIOS DE LOS MEDICAMENTOS EN LAS TRANSACCIONES INSTITUCIONALES. <Circular derogada por el artículo 12 de la Circular 12 de 2021> Los Mercados Relevantes listados a continuación estarán sujetos a monitoreo por parte de la CNPMDM considerando la diferencia entre el Precio de Referencia Internacional – PRI y el Precio de Referencia Nacional – PRN, así como el comportamiento estable de los precios en el mercado farmacéutico.
En caso de evidenciar incrementos injustificados en los precios, la Comisión podrá fijar como Precio Máximo de Venta, el Precio de Referencia Nacional, de acuerdo con lo dispuesto en el literal b) del artículo 19 de la Circular 03 de 2013.
<Consultar directamente modificaciones a este artículo, en el artículo 3 Circular 11 de 2020>

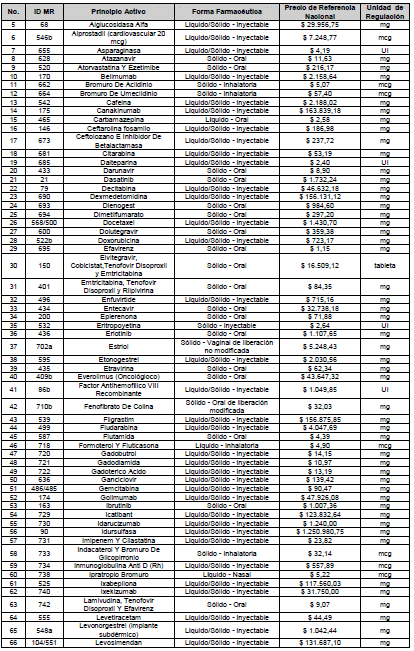
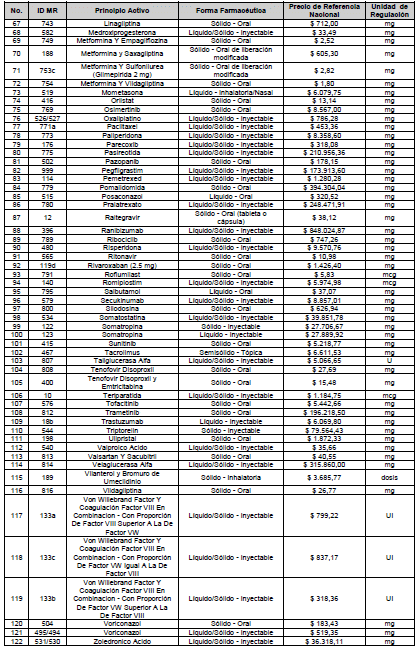
ARTÍCULO 7o. MARGEN ADICIONAL PARA LAS INSTITUCIONES PRESTADORAS DE SERVICIOS DE SALUD (IPS). <Circular derogada por el artículo 12 de la Circular 12 de 2021> Las Instituciones Prestadoras de Servicios de Salud podrán ajustar el precio regulado en los artículos 1o, 3o, 4o y 5o de la presente circular, de la siguiente manera:
7.1. Para las presentaciones comerciales con Precio Máximo de Venta menor o igual a $1.000.000, podrán adicionar un porcentaje hasta del 7%.
7.2. Para las presentaciones comerciales con Precio Máximo de Venta mayor a $1.000.000, podrán adicionar un porcentaje hasta del 3.5%.
PARÁGRAFO 1o. Este margen es exclusivamente para reconocer el valor que las IPS agregan a la cadena de distribución de los medicamentos.
PARÁGRAFO 2o. La Comisión observará el comportamiento de los precios de los medicamentos regulados y adoptará, en el marco de sus competencias, las medidas que sean del caso, con el fin de asegurar que, de adicionarse, se haga exclusivamente por parte de las IPS.
ARTÍCULO 8o. DESCRIPCIÓN DEL PRINCIPIO ACTIVO DE LOS MERCADOS RELEVANTES. <Circular derogada por el artículo 12 de la Circular 12 de 2021> En los casos en los que el principio activo regulado se encuentre registrado ante el Invima con código ATC que no coincida con el asignado por el Grupo de Investigación del Uso de Fármacos (Drug Utilization Research Group) de la Organización Mundial de la Salud (OMS), para efectos regulatorios se tomará en cuenta la descripción del principio activo incluida en el registro sanitario.
ARTÍCULO 9o. REGULACIÓN DE FORMAS FARMACÉUTICAS. <Circular derogada por el artículo 12 de la Circular 12 de 2021> Si la descripción de la forma farmacéutica de un Mercado Relevante es “sólido – oral” y no existe un Mercado Relevante adicional con el mismo principio activo y una forma farmacéutica “sólido – oral de liberación modificada”, se entenderá que el precio para el Mercado Relevante con forma farmacéutica “sólido – oral” aplicará para todas las presentaciones con esta última forma farmacéutica, independientemente de que modifique o no la liberación del fármaco.
ARTÍCULO 10. PROHIBICIÓN DE INCREMENTAR EL PRECIO MÁXIMO DE VENTA POR INTERMEDIACIÓN. <Circular derogada por el artículo 12 de la Circular 12 de 2021> El Precio Máximo de Venta de los medicamentos listados en los artículos 1o y 3o de la presente Circular, serán el máximo permitido para realizar operaciones en la cadena de comercialización y ningún actor de la cadena que realice operaciones en las transacciones institucionales y comerciales definidas en el artículo 2o de la Circular 06 de 2018, podrán sobrepasar el precio regulado.
PARÁGRAFO. Lo dispuesto en el presente artículo no aplicará en las transacciones comerciales establecidas en el artículo 20 de la Circular 03 de 2013. Sin perjuicio de la libertad de precios para farmacias-droguerías y droguerías, la Comisión observará el comportamiento de los precios con el fin de garantizar que las reducciones se trasladen al consumidor final.
ARTÍCULO 11. REGÍMENES ESPECIALES Y DE EXCEPCIÓN EN SALUD. <Circular derogada por el artículo 12 de la Circular 12 de 2021> De acuerdo con lo previsto en el artículo 15 de la Circular 03 de 2013, la presente Circular aplica también para los regímenes Especiales y de Excepción en Salud.
ARTÍCULO 12. SANCIONES POR INCUMPLIMIENTO AL RÉGIMEN DE CONTROL DE PRECIOS. <Circular derogada por el artículo 12 de la Circular 12 de 2021> En virtud de lo dispuesto por el artículo 132 de la Ley 1438 de 2011, la Superintendencia de Industria y Comercio (SIC), sancionará las infracciones al régimen de control de precios de medicamentos establecidos en la presente Circular y las que continúen en dicho control en virtud de anteriores circulares.
ARTÍCULO 13. VIGENCIA Y DEROGATORIAS. <Circular derogada por el artículo 12 de la Circular 12 de 2021> La presente Circular rige a partir de su publicación y surte efectos dos (2) meses después; deroga las Circulares 04 de 2013, modificada por la Circular 05 del mismo año; la Circular 07 de 2013 salvo el artículo 1o, la Circular 01 de 2014; la Circular 04 de 2018, la Circular 07 de 2018, modificada por las Circulares 08 de 2018 y 09 de 2019.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 27 de enero de 2020.
El Ministro de Salud y Protección Social (e),
Iván Darío González Ortiz.
El Ministro de Comercio, Industria y Turismo (e),
Saúl Pineda Hoyos.
La Delegada del Presidente de la República,
Clara Elena Parra Beltrán.






